BEXEPRIL 20 COMPRIMES PELLICULES POUR CHIENS
2. Composition qualitative et quantitative
Un comprimé pelliculé sécable de 540,8 mg contient :
Substance(s) active(s) :
Bénazépril …………………………………………………………… (sous forme de chlorhydrate) (soit 20,0 mg de chlorhydrate de bénazépril)
| 18,42 mg
|
Excipient(s) :
Dioxyde de titane (E171) ………….……………………………… | 3,4176 mg |
Oxyde de fer jaune (E172) ……….……………………………….. | 0,3424 mg |
Oxyde de fer rouge (E172)…….….……………………………..... | 0,2400 mg |
Pour la liste complète des excipients, voir rubrique « Liste des excipients ».
3. Forme pharmaceutique
Comprimé pelliculé.
Comprimés ronds, biconvexes, rouge orangé, avec une barre de sécabilité en croix sur une face.
Les comprimés peuvent être fractionnés en deux moitiés ou quarts égaux.
4. Informations cliniques
4.1. Espèces cibles
Chiens.
4.2. Indications d'utilisation, en spécifiant les espèces cibles
Chez les chiens de plus de 40 kg :
- Traitement de l'insuffisance cardiaque congestive associée, notamment, à une cardiomyopathie dilatée et/ou une insuffisance mitrale.
4.3. Contre-indications
Ne pas utiliser chez les chiens présentant une insuffisance du débit cardiaque, due à une sténose aortique par exemple.
Ne pas utiliser en cas d'hypersensibilité connue au principe actif ou à l'un des excipients.
Voir rubrique « Utilisation en cas de gestation, de lactation ou de ponte ».
4.4. Mises en garde particulières à chaque espèce cible
Aucune.
4.5. Précautions particulières d'emploi
i) Précautions particulières d'emploi chez l'animal
Aucun signe de toxicité rénale n'a été mis en évidence chez le chien lors des essais cliniques. Cependant, comme il est d'usage en cas d'insuffisance rénale, il est recommandé de surveiller la créatinine et l'urée plasmatiques pendant le traitement.
ii) Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Se laver les mains après utilisation.
En cas d'ingestion accidentelle, demander immédiatement conseil à un médecin et lui montrer la notice ou l'étiquetage.
Les femmes enceintes doivent être particulièrement vigilantes pour éviter toute ingestion accidentelle, car il a été montré que les IEC ont des effets sur le foetus en cas d'utilisation pendant la grossesse.
iii) Autres précautions
Aucune.
4.6. Effets indésirables (fréquence et gravité)
Dans de rares cas, des signes transitoires d'hypotension, tels que léthargie ou ataxie, peuvent survenir.
4.7. Utilisation en cas de gestation, de lactation ou de ponte
Ne pas utiliser chez les chiennes en gestation ou en lactation, ni chez les chiennes destinées à la reproduction.
Les études menées sur des animaux de laboratoire ont mis en évidence des effets embryotoxiques du bénazépril à des doses non maternotoxiques (anomalies des voies urinaires chez le foetus). L'innocuité du médicament n'a pas été évaluée en cas de gravidité ou de lactation chez la chienne.
Les études réalisées chez le rat et les observations faites chez l'homme ont mis en évidence des effets tératogènes.
4.8. Interactions médicamenteuses et autres formes d'interactions
Chez le chien insuffisant cardiaque, le bénazépril a été administré en association avec la digoxine, des diurétiques et des antiarythmiques sans que des interactions indésirables n'aient été mises en évidence.
Chez l'homme, l'association d'IEC et d'AINS peut entraîner une diminution de l'efficacité antihypertensive ou une altération de la fonction rénale. L'association du bénazépril avec d'autres antihypertenseurs (par exemple des inhibiteurs calciques, des bêtabloquants ou des diurétiques), ou encore avec des anesthésiques ou des sédatifs, peut entraîner des effets hypotenseurs supplémentaires. Par conséquent, l'utilisation concomitante d'AINS ou d'autres médicaments ayant un effet hypotenseur devra être envisagée avec prudence.
Il convient d'assurer une surveillance étroite de la fonction rénale et de rechercher attentivement les signes d'hypotension (léthargie, faiblesse, etc.), voire d'instaurer un traitement si nécessaire.
Des interactions avec les diurétiques épargneurs potassiques comme la spironolactone, le triamtérène ou l'amiloride ne peuvent pas être exclues. Compte tenu du risque de réactions mettant en jeu le pronostic vital, une surveillance du taux de potassium plasmatique est recommandée en cas d'utilisation du bénazépril en association avec un diurétique épargneur potassique. Comme avec d'autres IEC, l'utilisation de médicaments hypotenseurs ou d'anesthésiques ayant un effet hypotenseur est susceptible de renforcer l'effet antihypertenseur du bénazépril.
4.9. Posologie et voie d'administration
Voie orale exclusivement.
Pour garantir une posologie correcte, le poids corporel doit être déterminé aussi précisément que possible de façon à éviter un sous-dosage.
La dose orale recommandée est de 0,23 mg de bénazépril par kg de poids corporel par jour, équivalent à 0,25 mg de chlorhydrate de bénazépril par kg de poids corporel par jour, en une prise. La dose peut être doublée, toujours sur la base d'une administration quotidienne unique, si l'état clinique de l'animal le justifie et sur avis du vétérinaire.
Le bénazépril doit être administré par voie orale une fois par jour, avec ou sans nourriture. La durée du traitement n'est pas limitée.
Les comprimés peuvent être fractionnés en deux moitiés ou quarts égaux.
Pour diviser un comprimé sécable en quatre, placez-le sur une surface plane avec le côté rainuré vers le haut et appliquez une pression sur le milieu avec votre pouce.
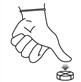
Pour diviser un comprimé en deux parties, placez le comprimé sur une surface plane avec la face sécable vers le haut, tenez une moitié du comprimé et appuyez sur l'autre moitié.
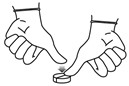
4.10. Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Chez le chien en bonne santé, un surdosage atteignant jusqu'à 200 fois la dose s'est révélé asymptomatique.
Une hypotension transitoire réversible peut survenir en cas de surdosage accidentel. Le traitement symptomatique consiste à administrer un sérum physiologique isotonique tiède par perfusion intraveineuse.
4.11. Temps d'attente
Sans objet.
5. Propriétés pharmacologiques
Groupe pharmacothérapeutique : inhibiteurs de l'enzyme de conversion (IEC), bénazépril.
Code ATC-vet : QC09AA07.
5.1. Propriétés pharmacodynamiques
Le chlorhydrate de bénazépril est une prodrogue qui est hydrolysée in vivo en son métabolite actif, le bénazéprilate. Le bénazéprilate est un inhibiteur sélectif de l'enzyme de conversion de l'angiotensine (IEC) qui empêche la conversion de l'angiotensine I inactive en angiotensine II active. En conséquence, le bénazéprilate inhibe les effets de l'angiotensine II, notamment la vasoconstriction artérielle et veineuse ainsi que la rétention hydrosodée d'origine rénale et les effets de remodelage (dont l'hypertrophie cardiaque pathologique).
Le médicament induit une inhibition prolongée de l'activité de l'enzyme de conversion de l'angiotensine plasmatique chez le chien : l'inhibition est significative et persiste 24 heures après une dose unique. Chez le chien insuffisant cardiaque, il abaisse la pression artérielle et diminue la charge volumique imposée au coeur.
5.2. Caractéristiques pharmacocinétiques
Après administration orale du chlorhydrate de bénazépril, les pics de concentration du bénazépril sont atteints rapidement (tmax = 1,74 h chez le chien). Les concentrations diminuent ensuite rapidement car le produit est en partie métabolisé en bénazéprilate par les enzymes hépatiques, le reste étant constitué de bénazépril sous forme inchangée et de métabolites hydrophiles. Chez le chien, les pics de concentration du bénazéprilate (Cmax = 35,02 ng/ml après une dose de 0,5 mg/kg de chlorhydrate de bénazépril) sont atteints à 1,74 h (Tmax). La biodisponibilité systémique est incomplète (environ 13 % chez le chien) du fait d'une absorption incomplète (38 %) et du métabolisme de premier passage.
Les concentrations en bénazéprilate diminuent selon un schéma biphasique : la phase initiale rapide (t1/2 = 1,7 h chez le chien) correspond à l'élimination du produit libre, tandis que la phase terminale (t1/2 ~ 19 h chez le chien) reflète la libération du bénazéprilate qui était lié à l'enzyme de conversion de l'angiotensine, principalement dans les tissus. Le bénazépril et le bénazéprilate sont fortement liés aux protéines plasmatiques et dans les tissus, on les retrouve essentiellement au niveau du foie et du rein.
Le profil pharmacocinétique du bénazéprilate ne présente pas de différence significative lorsque le chlorhydrate de bénazépril est administré chez le chien nourri ou à jeun.
L'administration répétée de bénazépril entraîne une légère bioaccumulation de bénazéprilate (R = 1,47 chez le chien à la dose de 0,5 mg/kg), l'état d'équilibre étant atteint en quelques jours (4 jours chez le chien).
Le bénazéprilate est excrété à 54 % par voie biliaire et à 46 % par voie urinaire chez le chien. La clairance du bénazéprilate n'est pas affectée chez les chiens dont la fonction rénale est altérée et il n'est par conséquent pas nécessaire d'adapter la dose de bénazépril en cas d'insuffisance rénale.
6. Informations pharmaceutiques
6.1. Liste des excipients
Noyau :
Lactose monohydraté
Amidon de maïs
Cellulose microcristalline
Silice colloïdale anhydre
Crospovidone
Talc
Stéarate de magnésium
Pelliculage :
Arôme de viande grillée
Opadry II rose
Composé de : alcool polyvinylique
Dioxyde de titane (E171)
Macrogol 3350
Talc (E553b)
Oxyde de fer jaune (E172)
Oxyde de fer rouge (E172)
6.2. Incompatibilités majeures
Aucune connue.
6.3. Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 24 mois.
La portion restante de comprimés doit être administrée lors de la prochaine administration.
6.4. Précautions particulières de conservation
Ne pas conserver à une température supérieure à 25 °C.
Conserver dans l'emballage extérieur d'origine, à l'abri de la lumière.
Replacer tout demi-comprimé non utilisé dans l'alvéole ouverte de la plaquette thermoformée et remettre la plaquette dans la boîte en carton.
6.5. Nature et composition du conditionnement primaire
Plaquette thermoformée PVC/PE/PVDC - aluminium
6.6. Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
7. Titulaire de l'autorisation de mise sur le marché
CHANELLE PHARMACEUTICALS MANUFACTURING LIMITED
DUBLIN ROAD, LOUGHREA
- CO. GALWAY
IRLANDE
8. Numéro(s) d'autorisation de mise sur le marché
FR/V/5503376 1/2010
Boîte de 1 plaquette de 14 comprimés pelliculés sécables
Boîte de 1 plaquette de 15 comprimés pelliculés sécables
Boîte de 2 plaquettes de 14 comprimés pelliculés sécables
Boîte de 2 plaquettes de 15 comprimés pelliculés sécables
Boîte de 3 plaquettes de 14 comprimés pelliculés sécables
Boîte de 3 plaquettes de 15 comprimés pelliculés sécables
Boîte de 4 plaquettes de 14 comprimés pelliculés sécables
Boîte de 4 plaquettes de 15 comprimés pelliculés sécables
Boîte de 5 plaquettes de 14 comprimés pelliculés sécables
Boîte de 5 plaquettes de 15 comprimés pelliculés sécables
Boîte de 6 plaquettes de 14 comprimés pelliculés sécables
Boîte de 6 plaquettes de 15 comprimés pelliculés sécables
Boîte de 7 plaquettes de 14 comprimés pelliculés sécables
Boîte de 7 plaquettes de 15 comprimés pelliculés sécables
Boîte de 8 plaquettes de 14 comprimés pelliculés sécables
Boîte de 8 plaquettes de 15 comprimés pelliculés sécables
Boîte de 9 plaquettes de 14 comprimés pelliculés sécables
Boîte de 9 plaquettes de 15 comprimés pelliculés sécables
Boîte de 10 plaquettes de 14 comprimés pelliculés sécables
Boîte de 10 plaquettes de 15 comprimés pelliculés sécables
Boîte de 11 plaquettes de 14 comprimés pelliculés sécables
Boîte de 11 plaquettes de 15 comprimés pelliculés sécables
Boîte de 12 plaquettes de 14 comprimés pelliculés sécables
Boîte de 12 plaquettes de 15 comprimés pelliculés sécables
Boîte de 13 plaquettes de 14 comprimés pelliculés sécables
Boîte de 13 plaquettes de 15 comprimés pelliculés sécables
Boîte de 14 plaquettes de 14 comprimés pelliculés sécables
Boîte de 14 plaquettes de 15 comprimés pelliculés sécables
Boîte de 15 plaquettes de 15 comprimés pelliculés sécables
Boîte de 16 plaquettes de 14 comprimés pelliculés sécables
Boîte de 16 plaquettes de 15 comprimés pelliculés sécables
Boîte de 17 plaquettes de 14 comprimés pelliculés sécables
Boîte de 17 plaquettes de 15 comprimés pelliculés sécables
Boîte de 18 plaquettes de 14 comprimés pelliculés sécables
Boîte de 18 plaquettes de 15 comprimés pelliculés sécables
Boîte de 19 plaquettes de 14 comprimés pelliculés sécables
Boîte de 19 plaquettes de 15 comprimés pelliculés sécables
Boîte de 20 plaquettes de 14 comprimés pelliculés sécables
Boîte de 20 plaquettes de 15 comprimés pelliculés sécables
Boîte de 21 plaquettes de 14 comprimés pelliculés sécables
Boîte de 21 plaquettes de 15 comprimés pelliculés sécables
Boîte de 22 plaquettes de 14 comprimés pelliculés sécables
Boîte de 25 plaquettes de 14 comprimés pelliculés sécables
Boîte de 26 plaquettes de 15 comprimés pelliculés sécables
Boîte de 28 plaquettes de 14 comprimés pelliculés sécables
Boîte de 30 plaquettes de 15 comprimés pelliculés sécables
Boîte de 32 plaquettes de 14 comprimés pelliculés sécables
Boîte de 36 plaquettes de 15 comprimés pelliculés sécables
Boîte de 39 plaquettes de 14 comprimés pelliculés sécables
Boîte de 40 plaquettes de 15 comprimés pelliculés sécables
Boîte de 43 plaquettes de 14 comprimés pelliculés sécables
Boîte de 47 plaquettes de 15 comprimés pelliculés sécables
Boîte de 50 plaquettes de 14 comprimés pelliculés sécables
Boîte de 54 plaquettes de 15 comprimés pelliculés sécables
Boîte de 57 plaquettes de 14 comprimés pelliculés sécables
Boîte de 60 plaquettes de 15 comprimés pelliculés sécables
Boîte de 64 plaquettes de 14 comprimés pelliculés sécables
Boîte de 67 plaquettes de 15 comprimés pelliculés sécables
Boîte de 71 plaquettes de 14 comprimés pelliculés sécables
Boîte de 72 plaquettes de 14 comprimés pelliculés sécables
Toutes les présentations peuvent ne pas être commercialisées.
9. Date de première autorisation/renouvellement de l'autorisation
09/04/2010 - 22/12/2014
10. Date de mise à jour du texte
23/02/2024