CEPRITECT 250 MG SUSPENSION INTRAMAMMAIRE POUR VACHES AU TARISSEMENT
2. Composition qualitative et quantitative
Une seringue intramammaire de 3 g contient : |
|
| |
Substance(s) active(s) : |
|
Céfalonium ..…………………………………………….. | 250 mg |
(sous forme de dihydrate) |
|
Pour la liste complète des excipients, voir rubrique « Liste des excipients ».
3. Forme pharmaceutique
Suspension intramammaire.
Suspension homogène de couleur blanchâtre à beige.
4. Informations cliniques
4.1. Espèces cibles
Bovins (vaches au tarissement).
4.2. Indications d'utilisation, en spécifiant les espèces cibles
Chez les vaches au tarissement :
Traitement des mammites subcliniques et prévention des nouvelles infections de la mamelle au tarissement causées par Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis, Trueperella pyogenes, Escherichia coli et Klebsiella spp. sensibles au céfalonium
4.3. Contre-indications
Ne pas utiliser chez les animaux présentant une hypersensibilité connue aux céphalosporines, à d'autres antibiotiques de la classe des β-lactamines ou à l’un des excipients.
Voir rubrique « Utilisation en cas de gestation, de lactation ou de ponte ».
4.4. Mises en garde particulières à chaque espèce cible
Aucune.
4.5. Précautions particulières d'emploi
i) Précautions particulières d'emploi chez l'animal
L'utilisation du produit doit être basée sur des tests de sensibilité des bactéries isolées de l'animal. Si cela n'est pas possible, le traitement doit être fondé sur des informations épidémiologiques locales (région, élevage) concernant la sensibilité des bactéries cibles.
L'utilisation du produit en dehors des recommandations du RCP peut augmenter la prévalence des bactéries résistantes au céfalonium et peut diminuer l'efficacité du traitement avec d'autres β-lactamines.
L'efficacité du produit n'a été établie que pour les germes mentionnés à la rubrique « Indications d'utilisation ». En conséquence, une mammite aigue grave (pouvant être mortelle) due à d'autres germes pathogènes, en particulier Pseudomonas aeruginosa, peut survenir à la suite du tarissement. Des règles d'hygiène strictes lors de l'administration du produit doivent être scrupuleusement respectées pour diminuer ce risque.
ii) Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Se laver les mains après utilisation du produit.
Les pénicillines et les céphalosporines peuvent provoquer une hypersensibilité (allergie) suite à leur injection, inhalation, ingestion ou au contact avec la peau. L'hypersensibilité aux pénicillines peut conduire à des hypersensibilités croisées avec les céphalosporines et vice versa. Les réactions allergiques à ces substances peuvent être graves.
Ne pas manipuler ce produit en cas d'allergie ou s'il vous a été conseillé de ne pas entrer en contact avec ce type de molécule.
Manipuler ce produit avec précaution pour éviter les expositions et suivre les précautions recommandées.
Si des symptômes tels que des rougeurs cutanées apparaissent après exposition, consulter un médecin et lui montrer cet avertissement. Un œdème de la face, des lèvres ou des yeux ou des difficultés respiratoires sont des symptômes plus sérieux qui requièrent une consultation médicale immédiate.
Les lingettes de nettoyage fournies avec le produit intramammaire contiennent de l’alcool isopropylique. Porter des gants de protection en cas d’irritation cutanée connue ou suspectée due à l’alcool isopropylique. Éviter un contact avec les yeux car l’alcool isopropylique peut provoquer une irritation oculaire.
iii) Autres précautions
Aucune.
4.6. Effets indésirables (fréquence et gravité)
Dans de très rares cas, des réactions allergiques immédiates ont été décrites chez certains animaux (agitation, tremblement, œdème de la mamelle, des paupières et des lèvres). Ces réactions peuvent entraîner la mort.
La fréquence des effets indésirables est définie en utilisant la convention suivante :
- très fréquent (effets indésirables chez plus d’1 animal sur 10 animaux traités)
- fréquent (entre 1 et 10 animaux sur 100 animaux traités)
- peu fréquent (entre 1 et 10 animaux sur 1 000 animaux traités)
- rare (entre 1 et 10 animaux sur 10 000 animaux traités)
- très rare (moins d’un animal sur 10 000 animaux traités, y compris les cas isolés).
4.7. Utilisation en cas de gestation, de lactation ou de ponte
Utiliser au cours du dernier trimestre de gestation au moment du tarissement.
Il n’y a pas d’effet indésirable du traitement sur le fœtus.
Ne pas utiliser chez les vaches pendant la lactation.
4.8. Interactions médicamenteuses et autres formes d'interactions
Les céphalosporines ne doivent pas être administrées simultanément avec des antibiotiques bactériostatiques.
L’utilisation concomitante de céphalosporines et de médicaments néphrotoxiques peut augmenter la toxicité rénale.
4.9. Posologie et voie d'administration
Voie intramammaire.
Administrer le contenu d’une seringue dans le canal du trayon de chaque quartier immédiatement après la dernière traite.
Éviter de contaminer l’extrémité de la seringue après avoir retiré le capuchon.
Avant l’administration, nettoyer et désinfecter l'orifice des trayons avec les lingettes fournies.
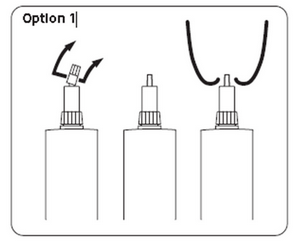
Option 1 : Insertion courte
Tenir la seringue et la base du capuchon avec une main. Avec l’autre main, tenir l’extrémité du capuchon puis effectuer une rotation pour la détacher. La base du capuchon reste alors sur l’embout. Attention à ne pas contaminer l’extrémité découverte de l’embout.
Option 1 : Insertion courte
Option 2 : Insertion longue
Retirer la totalité du capuchon en tenant la seringue dans la main et en poussant le capuchon avec le pouce pour le détacher.
Attention à ne pas contaminer l’embout.
Option 2 : Insertion longue
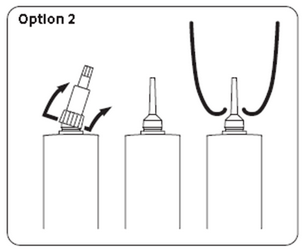
Insérer l’embout de la seringue dans le canal du trayon et appliquer une pression constante sur le piston de la seringue jusqu’à ce que toute la dose soit délivrée. Pincer légèrement l’extrémité du trayon avec une main et masser doucement vers le haut avec l’autre main afin de faciliter la diffusion de l’antibiotique dans le quartier.
Après administration, il est recommandé de procéder ensuite à un dernier trempage des trayons avec une solution désinfectante appropriée.
4.10. Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Une administration quotidienne répétée pendant 3 jours consécutifs n’a induit aucun effet indésirable.
4.11. Temps d'attente
Viande et abats : 21 jours.
Lait :
96 heures après le vêlage si la période de tarissement est supérieure à 54 jours,
58 jours après le traitement si la période de tarissement est inférieure ou égale à 54 jours.
5. Propriétés pharmacologiques
Groupe pharmacothérapeutique : Autres antibactériens de la famille des bêta-lactamines pour un usage intramammaire, céphalosporines de 1ère génération.
Code ATC-vet : QJ51DB90.
5.1. Propriétés pharmacodynamiques
Le céfalonium, est une céphalosporine de première génération, qui agit par inhibition de la synthèse de la paroi cellulaire bactérienne (action bactéricide). L’activité antibactérienne n’est pas modifiée par la présence de lait.
Trois mécanismes de résistance aux céphalosporines sont connus : réduction de la perméabilité de la paroi cellulaire, inactivation enzymatique et absence de sites spécifiques de liaison à la pénicilline.
Chez les bactéries Gram positif, en particulier les staphylocoques, le principal mécanisme de résistance est l’altération des protéines de liaison à la pénicilline. Chez les bactéries Gram négatif, la résistance peut passer par la production de β-lactamases, particulièrement les β-lactamases à spectre étendu (BLSE).
Le céfalonium est actif contre : Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis, Trueperella pyogenes, Escherichia coli et Klebsiella spp.
5.2. Caractéristiques pharmacocinétiques
Le céfalonium est largement mais lentement absorbé dans la mamelle et principalement excrété dans l’urine. Entre 7 % et 13 % de la substance active est éliminée dans l’urine chacun des 3 premiers jours post-administration alors que, pendant la même période, l’excrétion dans les fèces est inférieure à 1 %.
La concentration sanguine moyenne reste relativement constante pendant environ 10 jours après l’administration, ce qui est cohérent avec une absorption lente et prolongée du céfalonium au niveau la mamelle.
La persistance du céfalonium dans la mamelle tarie a été observée sur une période de 10 semaines après administration. Les niveaux de céfalonium dans les sécréta de la mamelle restent significatifs au cours de 10 semaines suivant l’administration.
6. Informations pharmaceutiques
6.1. Liste des excipients
Distéarate d'aluminium
Paraffine liquide
6.2. Incompatibilités majeures
Aucune connue.
6.3. Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25 °C.
6.5. Nature et composition du conditionnement primaire
Seringue intramammaire de 3 g en polyéthylène basse densité blanche
Capuchon sécable (pour insertion courte ou insertion longue) en polyéthylène basse densité blanc
6.6. Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
7. Titulaire de l'autorisation de mise sur le marché
NORBROOK LABORATORIES (IRELAND)
ROSSMORE INDUSTRIAL ESTATE
- MONAGHAN
IRLANDE
8. Numéro(s) d'autorisation de mise sur le marché
FR/V/8378151 5/2017
Boîte de 24 seringues intramammaires de 3 g et de 24 serviettes nettoyantes
Boîte de 60 seringues intramammaires de 3 g et de 60 serviettes nettoyantes
Seau de 120 seringues intramammaires de 3 g et de 120 serviettes nettoyantes
Toutes les présentations peuvent ne pas être commercialisées.
9. Date de première autorisation/renouvellement de l'autorisation
03/11/2017 - 28/01/2022
10. Date de mise à jour du texte
05/12/2022