CLIKZIN 12,5 MG/ML SUSPENSION POUR POUR-ON POUR OVINS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un mL contient : |
|
|
|
Substance active : |
|
|
|
Dicyclanil……………………………………………. | 12,50 mg |
|
|
Excipients : |
|
|
|
Composition qualitative en excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Jaune de quinoléine (E104) | 0,05 mg |
Bleu patenté V (E131) | 0,05 mg |
Parahydroxybenzoate de méthyle (E218) | 1,50 mg |
Parahydroxybenzoate de propyle (E216) | 3,00 mg |
Butylhydroxytoluène (E321) | 0,50 mg |
Polysorbate 20 |
|
Copolymère d'acide acrylique |
|
Edétate disodique |
|
Monoglycérides distillés |
|
Triglycérides à chaîne moyenne |
|
Propylène glycol |
|
Hydroxyde de sodium |
|
Eau purifiée |
|
Suspension de couleur verte pour pour-on.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Ovins.
3.2 Indications d'utilisation pour chaque espèce cible
Prévention des myiases à Lucilia sericata chez les moutons.
3.3 Contre-indications
Ne pas utiliser en cas d'hypersensibilité connue à la substance active ou à l'un des excipients.
3.4 Mises en garde particulières
Aucune.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Idéalement, le médicament vétérinaire doit être administré avant l'apparition d'un épisode de myiase ou lorsqu'une attaque est identifiée dans l'élevage ou à proximité. Des épisodes avérés de myiase peuvent nécessiter un traitement séparé avec un insecticide à effet rapide.
Il est recommandé de nettoyer la région périnéale des animaux avant application. Si un nettoyage ou une tonte de la région périnéale a lieu dans les semaines qui suivent l'application, ces animaux devront être retraités pour éviter une perte de protection.
Ne pas traiter pendant de fortes pluies ou lorsque de telles conditions sont attendues prochainement car il pourrait en résulter une diminution de la durée de protection.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
- Des rougeurs ou une irritation peut se développer à la suite d'un contact du médicament vétérinaire avec la peau ou les yeux.
- Le contact avec la peau et les yeux doit être évité.
- Le port de gants en caoutchouc synthétique et d'un pantalon en PVC est recommandé lors de l'application du médicament vétérinaire.
- En cas de contact avec la peau, retirer les vêtements contaminés et nettoyer soigneusement les parties du corps concernées avec de l'eau et du savon.
- En cas de contact avec les yeux, laver immédiatement à l'eau claire.
Toujours se laver les mains ainsi que la peau exposée avec l'eau et du savon après manipulation du médicament vétérinaire.
- Ne pas manger, boire ou fumer pendant l'application du médicament vétérinaire.
- Selon les règles de bonnes pratiques agricoles, toute manipulation de l'animal doit être évitée après le traitement. Si l'animal doit être manipulé au cours des 2 mois qui suivent le traitement, porter des gants en caoutchouc synthétique et un pantalon ou une combinaison. Si l'animal est mouillé, porter un pantalon imperméable.
Précautions particulières concernant la protection de l'environnement
Les ovins traités doivent être tenus à l'écart des cours d'eau pendant au moins une heure après le traitement. Si cette recommandation n'est pas suivie, il y a un risque grave pour les poissons et autres organismes aquatiques.
Autres précautions
Aucune.
3.6 Effets indésirables
Espèce cible : Ovins
Aucun connu.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation :
L’innocuité du médicament vétérinaire n’a pas été établie en cas de gestation ou de lactation.
L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque par le vétérinaire responsable. Les études en laboratoires chez les rats et les lapins n'ont pas mis en évidence d'effets tératogènes, fœtotoxiques, ou maternotoxiques.
3.8 Interactions médicamenteuses et autres formes d'interactions
Aucune connue.
3.9 Voies d'administration et posologie
Pour usage externe exclusivement.
Le médicament vétérinaire s'administre selon le schéma posologique suivant :
| Poids vif (kg) | Volume à administrer (mL) |
| 10-20 | 20 |
| 21-30 | 24 |
| 31-50 | 30 |
| >50 | 36 |
(Les volumes indiqués correspondent à une dose de 0,7 à 2 mL de suspension (soit 7,5 à 25 mg de dicyclanil) par kg de poids vif).
Pour une bonne posologie, le poids de l'animal doit être mesuré aussi précisément que possible, afin d'éviter le sous-dosage; s’assurer de la précision du matériel de dispensation.
Lors de traitements collectifs, rassembler les animaux selon leur poids et régler le dosage en fonction afin d’éviter tout surdosage ou sous-dosage.
Ne pas traiter les ovins ayant une toison de moins de 3 semaines.
Bien agiter le flacon avant utilisation.
Le médicament vétérinaire doit être appliqué au pistolet, manuel ou automatique, équipé d'une buse de pulvérisation, qui garantit une bonne répartition du produit sur la toison. Les meilleurs résultats sont obtenus en tenant le pistolet à environ 45 cm du mouton. Pulvériser le médicament en utilisant une méthode d’application en quatre étapes, comme indiqué sur le pictogramme, le long de la ligne du dos de l'animal sur une bande d'au moins 10 cm de large du garrot à la croupe (la moitié de la dose) et une bande décrivant un arc de cercle autour de l'arrière train et de la queue (reste de la dose).
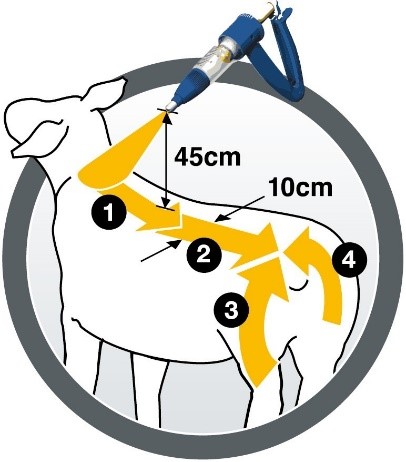
Le médicament vétérinaire doit être administré avant ou au début de la période d'infestation prévue mais peut également être utilisé pendant la saison des mouches.
Une application correcte permet une protection pendant 8 semaines. Selon les bonnes pratiques agricoles, il est recommandé de surveiller régulièrement les animaux.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Un surdosage supérieur à 20 fois la dose recommandée n'entraîne aucun signe d'intolérance locale ou systémique.
Aucun antidote n'est connu.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Viande et abats : 7 jours.
Ne pas utiliser chez les animaux producteurs de lait destiné à la consommation humaine.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QP53AX24.
4.2 Propriétés pharmacodynamiques
Le dicyclanil bloque la mue des premier et second stades larvaires de Lucilia spp. Il est moins efficace contre les stades larvaires plus mâtures et n'a pas d'effet sur la forme adulte.
Le mode d'action du dicyclanil est supposé similaire à celui des triazines.
4.3 Propriétés pharmacocinétiques
Les études montrent qu'environ 5 % d'une dose concentrée à plus de 5 % (p/v) de dicyclanil est absorbée puis éliminée dans l'urine et dans les fèces 7 jours après son administration. Le pic sanguin est atteint entre 12 à 48 heures après administration et représente moins de 0,025 mg d'équivalent dicyclanil par kg.
Lors d'études métaboliques expérimentales, la radioactivité absorbée était largement diffusée dans tout le corps. Les demi-vies les plus longues ont été trouvées dans le foie et les reins et étaient respectivement de 13 et 10 jours.
Le dicyclanil sous forme non métabolisée représente le principal résidu retrouvé dans le muscle, la graisse et la laine. Dans le foie et les reins, les résidus principalement retrouvés sont le descyclopropyl-dicyclanil ainsi que le dicyclanil sous forme non métabolisée.
Dans des études sur la déplétion des résidus, réalisées sur des moutons traités avec le médicament vétérinaire, les taux de résidus à 7 jours sont très faibles (un maximum de 31,9 et 30,7 µg/kg respectivement dans le foie et les reins, et pas de résidus quantifiables dans les muscles ou la graisse), indiquant une absorption systémique minimale.
Propriétés environnementales
L'utilisation de la spécialité est toxique pour les mouches coprophiles, et peut affecter les bousiers.
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
Durée de conservation après première ouverture du conditionnement primaire : 1 an.
5.3 Précautions particulières de conservation
À conserver à l’abri du gel.
À conserver dans l’emballage d’origine.
Conserver l’emballage soigneusement fermé, à distance de toute nourriture, boisson, et des aliments pour animaux.
Protéger des rayons directs du soleil.
5.4 Nature et composition du conditionnement primaire
L’emballage est composé d’un flacon en polyéthylène haute densité, blanc opaque, avec un bouchon à vis en polypropylène bleu, contenant 0,8, 2,2 ou 5 litres de produit fini.
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Le médicament vétérinaire ne doit pas être déversé dans les cours d’eau car la substance active pourrait mettre les poissons et autres organismes aquatiques en danger.
Ne pas contaminer les plans ou cours d'eau avec le produit ou les emballages vides.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
ELANCO
HEINZ-LOHMANN-STRASSE 4
27472 CUXHAVEN
ALLEMAGNE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/3885778 4/2010
Flacon de 0,8 L
Flacon de 2,2 L
Flacon de 5 L
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
12/07/2010 - 02/06/2015
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
15/05/2023
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).