CLINDASEPTIN 300 MG COMPRIMES
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un comprimé contient : |
|
|
|
Substance(s) active(s) : |
|
300 mg de Clindamycine (sous forme de chlorhydrate) | |
Excipient(s) :
Composition qualitative en excipients et autres composants |
Ludipress (lactose monohydraté, povidone, crospovidone) |
Laurilsulfate de sodium |
Silice colloïdale anhydre |
Stéarate de magnésium |
Arôme viande grillée |
Cellulose microcristalline |
Comprimé uni, blanc à blanc cassé, portant une barre de sécabilité en croix sur une face.
Les comprimés peuvent être divisés en moitiés ou en quarts.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chiens.
3.2 Indications d'utilisation pour chaque espèce cible
Traitement des plaies infectées, des abcès et des infections de la cavité buccale et dentaires causées par ou associées aux germes sensibles à la clindamycine Staphylococcus spp., Streptococcus spp., Bacteroides spp., Fusobacterium necrophorum et Clostridium perfringens et traitement de l’ostéomyélite à Staphylococcus aureus.
3.3 Contre-indications
Ne pas administrer aux lapins, hamsters, cobayes, chinchillas, chevaux ou ruminants car l'ingestion de la clindamycine par ces espèces pourrait provoquer de graves troubles gastro-intestinaux.
Ne pas utiliser en cas d'hypersensibilité connue aux lincosamides.
3.4 Mises en garde particulières
Une résistance croisée a été démontrée entre la clindamycine et la lincomycine chez le(s) pathogène(s) cible(s), ce qui est également courant avec l'érythromycine et d'autres antibiotiques macrolides.
L'utilisation de la clindamycine doit être envisagée avec précaution lorsque l'antibiogramme a révélé une résistance à la lincomycine, à l'érythromycine et à d'autres macrolides, car son efficacité peut être réduite.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Lors d'un traitement se prolongeant pendant au moins un mois, des tests de l'exploration fonctionnelle hépatique et rénale et des hémogrammes doivent être périodiquement effectués. Chez les chiens ayant des troubles rénaux et/ou hépatiques graves, s'accompagnant de graves aberrations métaboliques, la posologie à administrer doit être déterminée avec soin et leur état doit être surveillé en effectuant des analyses sériques pendant le traitement.
Quand cela est possible, le traitement par le médicament vétérinaire doit reposer sur des tests de sensibilité.
L'utilisation du produit doit être basée sur des tests d’identification et de sensibilité du(des) pathogène(s) cible(s). Si cela n'est pas possible, le traitement doit être déterminé à partir des données épidémiologiques et de la connaissance de la sensibilité des pathogènes cibles au niveau de l'exploitation ou au niveau local/régional.
L'utilisation du produit doit être conforme aux politiques antimicrobiennes officielles, nationales et régionales.
Un antibiotique présentant un risque plus faible de sélection de résistance aux antimicrobiens (catégorie AMEG inférieure) devrait être utilisé pour le traitement de première intention lorsque les tests de sensibilité suggèrent l'efficacité probable de cette approche.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Bien se laver les mains après l'administration du produit.
Les personnes ayant une hypersensibilité connue aux lincosamides (lincomycine, clindamycine) ne doivent pas manipuler ce médicament vétérinaire.
Ne pas manger, boire ou fumer pendant la manipulation du produit.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Chiens :
Fréquence indéterminée | Vomissements et diarrhées1 Prolifération bactérienne dans l’intestin grêle2 |
1 Des vomissements et des diarrhées sont occasionnellement observés.
2 La clindamycine peut favoriser la prolifération des germes non sensibles tels que les clostridies résistantes et les levures. En cas de surinfection, des mesures appropriées doivent être prises en fonction de la situation clinique.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la rubrique « coordonnées » de la notice.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation:
L’innocuité du médicament vétérinaire n’a pas été établie en cas de gestation et de lactation.
L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
Des études de laboratoire réalisées avec de fortes doses chez le rat suggèrent que la clindamycine n'est pas tératogène et qu'elle n'affecte pas de manière significative les performances reproductrices des mâles et des femelles.
Fertilité :
L'innocuité du médicament vétérinaire n'a pas été établie chez les chiens mâles reproducteurs.
3.8 Interactions médicamenteuses et autres formes d'interactions
Des effets curarisants ont été observés avec la clindamycine, ce qui peut éventuellement amplifier l'activité d'autres curarisants. L'utilisation simultanée de tels produits doit être faite avec précaution.
Ne pas utiliser la clindamycine en même temps que le chloramphénicol ou des macrolides car leur site d'action est également la sous-unité 50-S, et il est possible que des effets antagonistes se développent.
Lors de l'usage simultané de la clindamycine et d'aminosides (par exemple la gentamicine), on ne peut exclure le risque d'interactions indésirables (insuffisance rénale aiguë).
3.9 Voies d'administration et posologie
Administration par voie orale.
Afin de garantir une posologie appropriée, le poids corporel doit être déterminé aussi précisément que possible
Plaies infectées, abcès ou infections de la cavité buccale et dentaires :
5,5 mg de clindamycine par kg toutes les 12 heures pendant 7 à 10 jours (soit un comprimé pour 54 kg de poids corporel deux fois par jour). Si aucune amélioration n'est observée après 4 jours, il sera nécessaire de vérifier à nouveau la sensibilité des germes.
Infections dentaires et parodontales : en cas de traitement dentaire/chirurgical dû à l'infection, le traitement peut être instauré avant l'intervention.
Ostéomyélite :
11 mg de clindamycine par kg toutes les 12 heures pendant au moins 4 semaines (soit 2 comprimés pour 54 kg de poids corporel deux fois par jour). Si aucune amélioration n'est observée après 14 jours, il sera nécessaire de vérifier à nouveau la sensibilité des germes.
Les comprimés peuvent être divisés en moitiés ou en quarts pour assurer un dosage précis.
Pour diviser un comprimé sécable en quarts, placez-le sur une surface plane avec le côté rainuré vers le haut et appliquez une pression sur le milieu avec votre pouce.
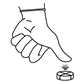
Pour diviser un comprimé en deux parties, placez le comprimé sur une surface plane avec la face sécable vers le haut, tenez une moitié du comprimé et appuyez sur l'autre moitié.
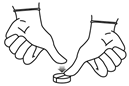
Remettre tous les morceaux divisés dans la plaquette thermoformée ou dans la boîte et utilisez-les dans les 72 heures. Les morceaux de comprimés doivent être utilisés lors de l’administration suivante. Les morceaux de comprimés restant après la dernière administration du produit doivent être jetés.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Aucun effet indésirable n'a été observé chez les chiens après l'administration de doses orales de 300 mg/kg.
Des vomissements, de l'inappétence, des diarrhées, une leucocytose et des augmentations des enzymes hépatiques (AST, ALT) ont été observés occasionnellement. Dans de tels cas, interrompre immédiatement le traitement et mettre en place un traitement symptomatique.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QJ01FF01
4.2 Propriétés pharmacodynamiques
La clindamycine est un antibiotique principalement bactériostatique appartenant au groupe des lincosamides. La clindamycine est un analogue chloré de la lincomycine.
Elle agit en inhibant la synthèse des protéines bactériennes. Le couplage réversible à la sous-unité 50-S du ribosome bactérien inhibe la translation des acides aminés liés à l’ARNt, empêchant ainsi l’élongation de la chaîne peptidique. C’est la raison pour laquelle le mode d’action de la clindamycine est principalement bactériostatique.
La clindamycine a montré une activité in vitro contre les germes suivants : Staphylococcus spp, Streptococcus spp, Bacteroides spp, Fusobacterium spp, Clostridium spp.
La clindamycine et la lincomycine ont des résistances croisées, ce qui est également courant entre l’érythromycine et d’autres antibiotiques de la famille des macrolides. Une résistance acquise peut également apparaître par méthylation du site de liaison ribosomique après mutation chromosomique par les germes Gram positif ou après médiation plasmidique par les germes Gram négatif.
4.3 Propriétés pharmacocinétiques
La clindamycine est presque entièrement absorbée après administration orale. Des concentrations sériques maximales de 3,3 µg/mL (sans jeûne) ou de 5,0 µg/mL (à jeun) sont obtenues approximativement 1 heure après l'administration d'une dose de 10 mg/kg.
La clindamycine est largement distribuée et peut se concentrer dans certains tissus.
La demi-vie d'élimination de la clindamycine est de l'ordre de 4 heures.
Approximativement 70 % de la clindamycine sont excrétés dans les selles et environ 30 % dans les urines.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
Sans objet.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente en flacon HDPE : 5 ans.
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente en plaquette thermoformée : 2 ans.
Remettre tous les morceaux divisés dans la plaquette thermoformée ou dans la boîte et utilisez-les dans les 72 heures.
5.3 Précautions particulières de conservation
Ce médicament vétérinaire ne nécessite pas de conditions particulières de conservation.
Les comprimés divisés doivent être conservés dans leur emballage d'origine. Conserver la plaquette dans l’emballage extérieur.
5.4 Nature et composition du conditionnement primaire
Flacon blanc en polyéthylène haute densité avec un bouchon sécurité enfant polypropylène contenant : 6, 10, 14, 16, 20, 28, 30, 42, 50, 56, 60, 70, 84, 98, 100 et 200 comprimés
Plaquette thermoformée aluminium trempe douce/aluminium trempe dure contenant : 6, 10, 14, 20, 28, 30, 42, 50, 56, 60, 70, 84, 98, 100, 140, 180, 200, 250, 280, 300, 500 et 1000 comprimés
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
CHANELLE PHARMACEUTICALS MANUFACTURING LIMITED
DUBLIN ROAD, LOUGHREA
- CO. GALWAY
IRLANDE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/7239297 1/2009
Boîte de 3 plaquettes thermoformées de 2 comprimés sécables
Boîte de 5 plaquettes thermoformées de 2 comprimés sécables
Boîte de 7 plaquettes thermoformées de 2 comprimés sécables
Boîte de 10 plaquettes thermoformées de 2 comprimés sécables
Boîte de 14 plaquettes thermoformées de 2 comprimés sécable
Boîte de 15 plaquettes thermoformées de 2 comprimés sécables
Boîte de 21 plaquettes thermoformées de 2 comprimés sécables
Boîte de 25 plaquettes thermoformées de 2 comprimés sécables
Boîte de 28 plaquettes thermoformées de 2 comprimés sécables
Boîte de 30 plaquettes thermoformées de 2 comprimés sécables
Boîte de 35 plaquettes thermoformées de 2 comprimés sécables
Boîte de 42 plaquettes thermoformées de 2 comprimés sécables
Boîte de 49 plaquettes thermoformées de 2 comprimés sécables
Boîte de 50 plaquettes thermoformées de 2 comprimés sécables
Boîte de 70 plaquettes thermoformées de 2 comprimés sécables
Boîte de 90 plaquettes thermoformées de 2 comprimés sécables
Boîte de 100 plaquettes thermoformées de 2 comprimés sécables
Boîte de 125 plaquettes thermoformées de 2 comprimés sécables
Boîte de 140 plaquettes thermoformées de 2 comprimés sécables
Boîte de 150 plaquettes thermoformées de 2 comprimés sécables
Boîte de 250 plaquettes thermoformées de 2 comprimés sécables
Boîte de 500 plaquettes thermoformées de 2 comprimés sécables
Flacon de 35 mL contenant 6 comprimés sécables
Flacon de 35 mL contenant 10 comprimés sécables
Flacon de 75 mL contenant 14 comprimés sécables
Flacon de 75 mL contenant 16 comprimés sécables
Flacon de 75 mL contenant 20 comprimés sécables
Flacon de 100 mL contenant 28 comprimés sécables
Flacon de 100 mL contenant 30 comprimés sécables
Flacon de 150 mL contenant 42 comprimés sécables
Flacon de 150 mL contenant 50 comprimés sécables
Flacon de 150 mL contenant 56 comprimés sécables
Flacon de 150 mL contenant 60 comprimés sécables
Flacon de 250 mL contenant 70 comprimés sécables
Flacon de 250 mL contenant 84 comprimés sécables
Flacon de 300 mL contenant 98 comprimés sécables
Flacon de 300 mL contenant 100 comprimés sécables
Flacon de 600 mL contenant 200 comprimés sécables
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
29/05/2009 - 27/09/2012
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
11/04/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary)