CYDECTINE 10 % LA SOLUTION INJECTABLE POUR BOVINS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un mL contient : |
|
|
|
Substance(s) active(s) : |
|
|
|
Moxidectine ………………. | 100 mg |
Excipient(s) :
Composition qualitative en excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Alcool benzylique (E1519) | 70,0 mg |
Monooléate de sorbitan (Crill 4HP) | / |
Propylène glycol dicaprylate / dicaprate | / |
Solution injectable jaune clair.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Bovins.
3.2 Indications d'utilisation pour chaque espèce cible
Chez les bovins de 100 à 500 kg, traitement curatif et préventif des infestations mixtes par les nématodes gastro-intestinaux, les nématodes de l'appareil respiratoire et certains parasites arthropodes suivants :
- Nématodes gastro-intestinaux adultes et immatures :
. Haemonchus placei
. Haemonchus contortus
. Ostertagia ostertagi (y compris les larves inhibées)
. Trichostrongylus axei
. Trichostrongylus colubriformis
. Nematodirus helvetianus (adultes seulement)
. Nematodirus spathiger
. Cooperia surnabada
. Cooperia oncophora
. Cooperia pectinata
. Cooperia punctata
. Oesophagostomum radiatum
. Bunostomum phlebotomum (adultes seulement)
. Chabertia ovina (adultes seulement)
. Trichuris spp. (adultes seulement)
- Nématodes adultes et immatures de l'appareil respiratoire :
. Dictyocaulus viviparus
- Hypodermes (larves en migration) :
. Hypoderma bovis
. Hypoderma lineatum
- Poux :
. Linognathus vituli
. Haematopinus eurysternus
. Solenopotes capillatus
. Bovicola bovis (réduction de l'infestation)
- Acariens responsables de la gale :
. Sarcoptes scabiei
. Psoroptes ovis
. Chorioptes bovis (réduction de l'infestation)
Le médicament a une action rémanente et protège les bovins d'une façon durable contre les infestations et les ré-infestations par les parasites suivants durant les périodes indiquées :
Espèces | Période de protection (jours) |
Dictyocaulus viviparus | 120 |
Ostertagia ostertagi | 120 |
Haemonchus placei | 90 |
Oesophagostomum radiatum | 150 |
Trichostrongylus axei | 90 |
Linognathus vituli | 133 |
Le médicament vétérinaire est efficace contre les larves d'hypodermes au moment du traitement mais l'activité rémanente sur les hypodermes n'a pas été évaluée.
Si le médicament vétérinaire est administré avant la fin de la saison des mouches, un traitement additionnel contre l'hypodermose peut être requis.
Les rémanences n'ont pas été établies pour les espèces de parasites autres que celles listées ci-dessus, c'est pourquoi, la ré-infestation des animaux présents sur des pâtures contaminées par des parasites autres que ceux-ci est possible avant la fin de la période de rémanence minimale de 90 jours démontrée pour des espèces spécifiques.
3.3 Contre-indications
Ne pas utiliser chez les animaux de moins de 100 kg de poids vif ou de plus de 500 kg de poids vif.
Ne pas injecter le médicament vétérinaire par voie intravasculaire. L’injection intravasculaire peut entrainer ataxie, paralysie, convulsions, collapsus et la mort. Pour prévenir toute injection intravasculaire, respecter soigneusement la procédure d’administration décrite en rubrique « Voies d’administration et posologie ».
3.4 Mises en garde particulières
Une utilisation non justifiée d’antiparasitaires ou s'écartant des instructions du RCP peut augmenter la pression de sélection de la résistance et conduire à une efficacité réduite. La décision d'utiliser le produit doit être basée sur la confirmation de l'espèce et de la charge parasitaires, ou du risque d'infestation sur la base de ses caractéristiques épidémiologiques, pour chaque troupeau.
Des précautions doivent être prises afin d'éviter les pratiques suivantes car elles augmentent le risque de développement de résistance et peuvent rendre le traitement inefficace :
- usage trop fréquent et répété d'anthelminthiques de la même classe pendant une durée prolongée. L’utilisation répétée pendant une période prolongée, en particulier lorsqu’il s’agit de la même classe de substances, augmente le risque de développement d’une résistance. Au sein d’un troupeau, le maintien de refuges sensibles est essentiel pour réduire ce risque. Il convient d’éviter d’administrer les traitements de façon systématique par intervalles et de traiter l’ensemble d’un troupeau. Au lieu de cela, si possible, seuls certains animaux ou sous-groupes doivent être traités (traitement sélectif ciblé). Ces mesures doivent être combinées à des mesures appropriées d’élevage et de gestion des pâturages. Des conseils pour chaque troupeau spécifique peuvent être obtenus auprès du vétérinaire responsable ;
- sous-dosage pouvant être lié à une sous-estimation du poids vif, une mauvaise administration du médicament vétérinaire, un manque d'étalonnage du dispositif de dosage (s'il en existe un).
Les cas cliniques suspects de résistance aux anthelminthiques doivent faire l'objet d'analyses complémentaires en effectuant les tests appropriés (par exemple le test de réduction de l'excrétion des œufs dans les fèces). En cas de suspicion forte de résistance à un anthelminthique particulier suite aux tests, un anthelminthique appartenant à une autre classe pharmacologique et présentant un autre mécanisme d'action doit être utilisé.
Une résistance à la moxidectine a été signalée chez Cooperia spp. et Ostertagia spp. chez les bovins.
Psoroptes ovis est un parasite externe extrêmement contagieux chez les ovins et les bovins. Pour assurer un contrôle complet, il faut éviter la ré-infestation, puisque les agents de la gale peuvent survivre jusqu’à 15 jours hors de l’animal. Il est important de s'assurer que tous les animaux ayant été en contact avec des animaux infectés soient traités. Il est nécessaire d'éviter tout contact entre les troupeaux traités, infestés et non traités pendant au moins 7 jours après le traitement.
Une résistance à la moxidectine a été signalée chez les acariens de la gale Psoroptes ovis, chez les ovins et les bovins. Des cas de co-résistance avec d'autres lactones macrocycliques (ivermectine et doramectine) ont également été signalés. L'utilisation de ce produit doit tenir compte des informations locales sur la sensibilité des parasites cibles, lorsqu'elles sont disponibles.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Pour prévenir une éventuelle réaction de type anaphylactique, ne pas injecter le produit par voie intraveineuse.
Pour éviter les abcès, une asepsie stricte est recommandée.
Le médicament vétérinaire a été formulé tout particulièrement pour une injection sous-cutanée dans l'oreille de l'animal et ne doit pas être administré par une autre voie ou à d'autres espèces.
Pour éviter des réactions secondaires dues à la mort des larves d'hypodermes dans l'œsophage ou la colonne vertébrale, il est recommandé d'administrer le médicament à la fin de l'activité des mouches et avant que les larves n'atteignent leur site. Consulter le vétérinaire pour connaître la période correcte de traitement.
L'immunité sur les nématodes dépend d'une bonne exposition. Bien que ce ne soit pas le cas normalement, il peut arriver que des mesures de contrôle antiparasitaires accroissent la vulnérabilité des bovins à la ré-infestation. Les animaux courent des risques de ré-infestation vers la fin de leur première saison de pâture, spécialement si la saison est longue, ou bien l'année suivante, s'ils sont placés sur des pâtures extrêmement contaminées. Des mesures de contrôle complémentaires peuvent alors être envisagées.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Eviter le contact direct avec la peau et les yeux.
Se laver les mains après usage.
Ne pas fumer, boire ou manger en manipulant le médicament vétérinaire.
Veiller à ne pas s'auto-injecter le produit. Consulter un médecin généraliste en cas d'auto-injection accidentelle, traiter tout symptôme particulier.
Précautions particulières concernant la protection de l'environnement
La moxidectine remplit les critères pour être classée comme substance (très) persistante, bioaccumulable et toxique (PBT), par conséquent, l’exposition de l’environnement à la moxidectine doit être limitée autant que possible. Les traitements ne doivent être administrés que lorsque cela est nécessaire et doivent être basés sur le nombre d'œufs présents dans les excréments ou l’évaluation du risque d’infestation au niveau de l’animal et/ou du troupeau.
À l’instar des autres lactones macrocycliques, la moxidectine peut entraîner des effets indésirables pour les organismes non ciblés.
• Les excréments contenant de la moxidectine excrétés dans les prairies par des animaux traités peuvent temporairement réduire l’abondance d’organismes se nourrissant de fumier. Après avoir traité des bovins avec le médicament vétérinaire, des niveaux de moxidectine, potentiellement toxiques pour les espèces de mouches du fumier, peuvent être excrétés durant une période de plus de quatre semaines et peuvent réduire l’abondance de mouches du fumier durant cette période. Il a été établi lors d’essais en laboratoire que la moxidectine pouvait affecter temporairement la reproduction des coléoptères coprophages; toutefois, des études sur le terrain ont conclu à l’absence de tout effet sur le long terme. Néanmoins, en cas de traitements répétés avec la moxidectine (tout comme avec les médicaments vétérinaires de la même classe des anthelminthiques), il est conseillé de ne pas traiter à chaque fois les animaux dans la même prairie afin de permettre aux populations de faune du fumier de se rétablir.
• La moxidectine est intrinsèquement toxique pour les organismes aquatiques, y compris les poissons. Le médicament vétérinaire doit uniquement être utilisé conformément aux instructions de l’étiquetage. D’après le profil d’excrétion de la moxidectine lorsqu’elle est administrée sous forme de formulation injectable, les animaux traités ne doivent pas pouvoir accéder aux cours d’eau durant les 10 jours suivant le traitement.
Autres précautions
3.6 Effets indésirables
Bovins :
Rare (1 à 10 animaux / 10 000 animaux traités) : | Gonflement au site d’injection1,2 Dépression Ataxie |
Très rare ( < 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Abcès au site d’injection2 Réactions d’hypersensibilité3 Troubles neurologiques4 (tels que collapsus, convulsions, paralysie, cécité) |
1 immédiat ou retardé, peut dégénérer en abcès au site d’injection, la fréquence tend à être supérieure chez les animaux plus lourds.
2 disparaissent généralement sans traitement dans les 14 jours après administration, peuvent persister jusqu'à 5 semaines (< 5 % des cas) ou plus longtemps (très rares cas).
3 Si une telle réaction se produit, un traitement symptomatique doit être appliqué.
4 réactions graves pouvant être mortelles.
En cas de réaction d'hypersensibilité, traiter les signes cliniques de manière symptomatique.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la rubrique « coordonnées » de la notice.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation :
La spécialité peut être utilisée pendant la gestation. Cependant, voir la rubrique 3.3 « Contre-indications ».
3.8 Interactions médicamenteuses et autres formes d'interactions
Les effets des GABA agonistes sont augmentés par la moxidectine.
3.9 Voies d'administration et posologie
Voie sous-cutanée.
1 mg de moxidectine par kg de poids vif soit 0,5 mL de solution pour 50 kg de poids vif, en une injection unique par voie sous-cutanée à l'oreille en utilisant une aiguille hypodermique de G18 25-40 mm. Les bouchons des flacons de 50 mL ne doivent pas être perforés plus de 20 fois. Utiliser une seringue automatique pour le flacon de 200 mL.
Agiter vigoureusement avant utilisation.
Un sous-dosage pourrait entraîner une utilisation inefficace et favoriser le développement de résistances. Pour garantir l'administration d'un dosage correct, le poids corporel doit être déterminé aussi précisément que possible. Si les animaux doivent être traités collectivement, des groupes raisonnablement homogènes doivent être constitués, et tous les animaux d’un groupe doivent recevoir la dose correspondant à l’animal le plus lourd. La précision du dispositif de dosage doit être soigneusement vérifiée.
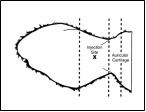
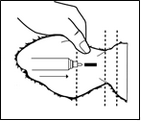
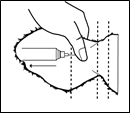
L'injection doit être réalisée par voie sous-cutanée dans les tissus lâches de la surface dorsale de l'oreille juste en arrière du bord du cartilage auriculaire.
Nettoyer la face dorsale de l'oreille avec un antiseptique et laisser sécher à l'air. Palper le bord du cartilage auriculaire le plus proche de la tête sur la face dorsale (poilue) de l'oreille. En maintenant ce repère et en évitant les vaisseaux sanguins (artère, veine), insérer l'aiguille sous la peau en partant d'un point à environ 3 - 3,5 cm de ce bord (par rapport à la tête), la diriger vers la base de l'oreille, et l'avancer vers le centre. A ce stade, aspirer légèrement avec la seringue pour s'assurer que l'aiguille n'ait pas pénétré un vaisseau sanguin.
Après injection, la solution devrait se trouver tout prêt du bord du cartilage auriculaire.
Après administration, retirer l'aiguille en exerçant une pression de quelques secondes avec le pouce sur le point d'insertion.
Etant donné la durée d'efficacité prolongée contre Dictyocaulus viviparus et les nématodes gastro-intestinaux, Ostertagia ostertagi et Haemonchus placei, un seul traitement avec le médicament lors de la mise en pâture permet de contrôler la bronchite parasitaire (nématode de l'appareil respiratoire) et la gastro-entérite parasitaire tout au long de la saison de pâture en réduisant l'accumulation de larves infectantes sur la pâture. Pour obtenir les meilleurs résultats l'injection doit se faire, juste avant la mise en pâture, à tous les veaux ayant atteint le poids requis, les animaux doivent être maintenus sur la même pâture tout au long de la saison ou déplacés vers une pâture n'ayant pas encore été pâturée durant la saison.
Diagramme : Injection dans l'oreille
|
|
|
|
|
|
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Les réactions au site d'injection se produisent plus fréquemment et de façon plus sévère en fonction du volume injecté. Les signes de surdosage découlent du mode d'action de la moxidectine. Les signes se manifestent sous forme de salivation transitoire, de dépression, de somnolence et d'ataxie et s'observent dans les 24 à 36 heures suivant le traitement. Aucun traitement particulier n'est généralement nécessaire et la guérison complète s'observe dans les 36 à 72 heures. A des doses supérieures à 3 fois la dose recommandée réparties sur les 2 oreilles, des signes systémiques incluant animal couché, tremblements musculaires, atonie ruminale et déshydratation, qui disparaissent après une thérapie liquidienne ont été rapportés. Les signes systémiques peuvent durer de quelques jours à dix jours. Il n'existe pas d'antidote spécifique.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Viande et abats : 108 jours.
Lait : interdit chez les animaux produisant du lait destiné à la consommation humaine. Ne pas utiliser chez les animaux en gestation destinés à produire du lait pour la consommation humaine durant les 80 jours qui précèdent la mise bas.
Le temps d'attente est basé sur une injection unique au niveau site d'injection de l'oreille.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QP54AB02.
4.2 Propriétés pharmacodynamiques
La moxidectine est un antiparasitaire actif contre un large éventail de parasites internes et externes. Il s'agit d'une lactone macrocyclique de seconde génération appartenant à la famille des milbémycines.
La moxidectine agit par interférence avec les récepteurs GABA et les canaux chlore.
L'effet résultant est l'ouverture des canaux chlore de la jonction post-synaptique et l'entrée des ions chlore induisant un état de repos irréversible. Ceci provoque une paralysie flasque avec mort éventuelle des parasites exposés à la moxidectine.
La résistance à la moxidectine est médiée en partie par les transporteurs membranaires P-glycoprotéines, et une résistance croisée avec d'autres lactones macrocycliques est possible.
4.3 Propriétés pharmacocinétiques
Après injection par voie sous cutanée, la moxidectine est absorbée et la concentration sanguine maximale est atteinte environ 24 à 48 heures après injection. La moxidectine diffuse dans l'ensemble des tissus, mais, en raison de sa liposolubilité, les concentrations sont observées essentiellement dans la graisse. La demi-vie dans la graisse est de 26 à 32 jours.
La moxidectine n'est que peu métabolisée par hydroxylation dans l'organisme. La seule voie d'excrétion significative est représentée par les fèces.
Propriétés environnementales
La moxidectine remplit les critères pour être qualifiée de substance (très) persistante, bioaccumulable et toxique (PBT). Plus particulièrement, dans des études sur la toxicité aiguë et chronique sur des algues, des crustacés et des poissons, la moxidectine a montré une toxicité pour ces organismes, donnant lieu aux résultats suivants :
Organisme | CE50 | CSEO | |
Algues | S.capricornutum | >86,9 µg/L | 86,9 µg/L |
Crustacés (puces d’eau) | Daphniamagna(aiguë) | 0,0302 µg/L | 0,011 µg/L |
Daphniamagna(reproduction) | 0,0031 µg/L | 0,010 µg/L | |
Poissons | O. mykiss | 0,160 µg/L | Indéterminée |
L. macrochirus | 0,620 µg/L | 0,52 µg/L | |
P.promelas (premiers stades de la vie) | Sans objet | 0,0032 µg/L | |
Cyprinuscarpio | 0,11 µg/L | Indéterminée | |
CE50 : concentration qui entraîne des effets indésirables chez 50 % des animaux d’une espèce testée, à savoir la mortalité et les effets sublétaux.
CSEO : dans l’étude, concentration à laquelle aucun effet n’est observé.
Cela signifie que lorsque la moxidectine pénètre dans des organismes aquatiques, cela peut avoir une incidence grave et durable sur la vie aquatique. Afin d’atténuer ce risque, toutes les précautions d’emploi et d’élimination doivent être respectées.
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente: 3 ans.
Durée de conservation après première ouverture du conditionnement primaire : 28 jours.
5.3 Précautions particulières de conservation
À conserver à une température ne dépassant pas 25º C. Conserver le flacon dans l’emballage extérieur de façon à le protéger de la lumière.
5.4 Nature et composition du conditionnement primaire
Flacon en PEHD
Bouchon en caoutchouc chlorobutyle avec revêtement Flurotec
Bague aluminium de flip off (flacon de 50 mL)
Bague aluminium (flacon 200 mL)
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Le médicament vétérinaire ne doit pas être déversé dans les cours d’eau car la moxidectine pourrait mettre les poissons et autres organismes aquatiques en danger.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
ZOETIS FRANCE
10 RUE RAYMOND DAVID
92240 MALAKOFF
FRANCE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/5341056 8/2005
Boîte de 1 flacon de 50 mL
Boîte de 1 flacon de 200 mL
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
17/01/2005 - 12/03/2010
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
08/04/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).