CYDECTINE TRICLAMOX 5 MG/ML + 200 MG/ML SOLUTION POUR POUR-ON POUR BOVINS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque mL contient : |
|
|
|
Substances actives : |
|
Moxidectine …………………………………………. | 5,0 mg |
Triclabendazole …………………………………….. | 200,0 mg |
Composition qualitative en excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Butylhydroxytoluène (E321) | 5,0 mg |
Gamma-hexalactone | / |
Cinéole | / |
Macrogolglycérides caprylocapriques | / |
Liquide clair de couleur ambrée.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Bovins.
3.2 Indications d'utilisation pour chaque espèce cible
Traitement des infestations mixtes par des trématodes (douve), des nématodes et/ou certains arthropodes, causées par des souches sensibles à la moxidectine et au triclabendazole :
| Parasites | Stades adultes | Stades inhibés | |
| NEMATODES | L4 | ||
| Nematodes gastro-intestinaux: | |||
| Haemonchus placei | X | X | |
| Ostertagia ostertagi | X | X | X |
| Trichostrongylus axei | X | X | |
| Nematodirus helvetianus | X | X | |
| Cooperia oncophora | X | X | |
| Cooperia punctata | X | ||
| Oesophagostomum radiatum | X | ||
| Bunostomum phlebotomum | X | ||
| Nematode du tractus Respiratoire: | |||
| Dictyocaulus viviparus | X | ||
| TREMATODES | |||
| Douves : | 6–8 semaines immatures | ||
| Fasciola hepatica | X | X | |
| ECTOPARASITES | |||
| Linognathus vituli | X | ||
| Bovicola bovis | X | ||
| Solenopotes capillatus | X |
Le produit a un effet rémanent et prévient la ré-infestation par Ostertagia ostertagi et Dictyocaulus viviparus pendant 5 semaines après un traitement unique.
3.3 Contre-indications
Ne pas utiliser en cas d'hypersensibilité connue à l'une des substances actives ou à l'un des excipients.
3.4 Mises en garde particulières
Veiller à éviter les pratiques suivantes, car elles augmentent le risque de développement de résistances et peuvent entraîner l'inefficacité d'un traitement :
- Utilisation trop fréquente et répétée des anthelminthiques de la même classe sur une période prolongée.
- Sous-dosage qui peut être dû à une sous-estimation du poids vif, à une mauvaise administration du produit, ou à un défaut de calibrage du dispositif d'administration (le cas échéant).
Les cas cliniques avec une suspicion de résistance aux anthelminthiques doivent être étudiés de manière approfondie en utilisant des tests appropriés (par exemple le test de réduction du nombre d'œufs dans les fèces). Lorsque les résultats du ou des tests suggèrent fortement une résistance à un anthelminthique particulier, un anthelminthique appartenant à une autre classe pharmacologique et ayant un mode d'action différent doit être utilisé.
La résistance à la moxidectine a été signalée principalement chez Cooperia oncophora dans certains pays européens. La résistance de certaines souches de Cooperia spp. à certaines lactones macrocycliques peut impliquer des résistances croisées avec la moxidectine. La résistance au triclabendazole a été signalée pour Fasciola hepatica chez les bovins dans un certain nombre de pays européens. Les souches de Fasciola hepatica résistantes au triclabendazole présentes chez les ovins peuvent se transmettre aux bovins mis sur la même pâture. Par conséquent, l'utilisation de ce médicament devrait s'appuyer sur des informations épidémiologiques locales (régionale, élevage) sur la sensibilité des parasites, l'historique local des traitements et les recommandations sur la manière d'utiliser le médicament dans des conditions durables pour limiter une émergence supplémentaire de résistance aux anthelminthiques.
Ne pas utiliser ce médicament vétérinaire pour traiter des infestations non mixtes.
Il a été montré qu'une pluie se produisant deux heures avant ou après le traitement n'affectait pas l'efficacité du produit.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Le produit a été spécialement formulé pour une application topique chez les bovins et il ne doit pas être administré par une autre voie ou sur une autre espèce.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Les personnes présentant une hypersensibilité connue à la substance active doivent éviter tout contact avec le médicament vétérinaire. Le médicament vétérinaire peut causer des irritations de la peau ou des yeux.
Eviter le contact direct avec la peau ou les yeux.
Un équipement de protection individuelle consistant en des gants, des vêtements de travail protecteurs et des lunettes de protection doit être porté lors de la manipulation du médicament vétérinaire.
En cas de projection accidentelle dans les yeux ou sur la peau, rincer immédiatement et abondamment avec de l'eau courante propre.
Si l'irritation persiste, consultez immédiatement un médecin et montrez-lui la notice ou l’étiquette.
Ne pas fumer, boire ou manger pendant l'utilisation du produit. Se laver les mains après usage.
Précautions particulières concernant la protection de l'environnement
La moxidectine remplit les critères pour être classée comme substance (très) persistante, bioaccumulable et toxique (PBT), par conséquent, l’exposition de l’environnement à la moxidectine doit être limitée autant que possible. Les traitements ne doivent être administrés que lorsque cela est nécessaire et doivent être basés sur le nombre d'œufs présents dans les excréments ou l’évaluation du risque d’infestation au niveau de l’animal et/ou du troupeau.
À l’instar des autres lactones macrocycliques, la moxidectine peut entraîner des effets indésirables pour les organismes non ciblés.
- Les excréments contenant de la moxidectine excrétés dans les prairies par des animaux traités peuvent temporairement réduire l’abondance d’organismes se nourrissant de fumier. Après avoir traité des bovins avec le produit, des niveaux de moxidectine, potentiellement toxiques pour les espèces de mouches du fumier, peuvent être excrétés durant une période de plus de deux semaines et peuvent réduire l’abondance de mouches du fumier durant cette période. Il a été établi lors d’essais en laboratoire que la moxidectine pouvait affecter temporairement la reproduction des coléoptères coprophages; toutefois, les études sur le terrain ne révèlent aucun effet sur le long terme. Néanmoins, en cas de traitements répétés avec la moxidectine (tout comme avec les produits de la même classe des anthelminthiques), il est conseillé de ne pas traiter à chaque fois les animaux dans la même prairie afin de permettre aux populations de faune du fumier de se rétablir.
- La moxidectine est intrinsèquement toxique pour les organismes aquatiques, y compris les poissons. Le produit doit uniquement être utilisé conformément aux instructions de l’étiquetage. D’après le profil d’excrétion de la moxidectine lorsqu’elle est administrée sous forme de formulation pour-on, les animaux traités ne doivent pas pouvoir accéder aux cours d’eau lors de la première semaine suivant le traitement.
Autres précautions
3.6 Effets indésirables
Bovins :
Très rare (< 1 animal / 10 000 animaux traités, y compris les cas isolés): | Irritations au site d’application, Troubles de l'appareil digestif (tels que diarrhée), Réaction d'hypersensibilité, Troubles neurologiques (tels que ataxie) |
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la rubrique « Coordonnées » de la notice.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation :
L'innocuité du produit a été démontrée chez les animaux en gestation et en lactation.
3.8 Interactions médicamenteuses et autres formes d'interactions
Aucune connue.
3.9 Voies d'administration et posologie
Usage externe uniquement.
0,5 mg de moxidectine par kg de poids vif et 20 mg de triclabendazole par kg de poids vif (soit 1 mL de solution pour 10 kg) par voie topique en une administration unique.
Administrer directement sur les poils et la peau de la ligne du dos de l'animal, des épaules à la queue.
Appliquer sur une peau propre et saine.
Pour permettre un dosage correct, le poids vif doit être déterminé le plus précisément possible. La précision du dispositif d'administration doit être vérifiée. Si les animaux doivent être traités collectivement plutôt qu'individuellement, il faut les regrouper en fonction de leur poids vif et leur administrer le médicament en conséquence, afin d'éviter tout sous ou surdosage.
Agiter avant utilisation.
Instructions d'utilisation avec une chambre de dosage (flacons de 500 mL et de 1 litre) :
- Etape 1 : Retirer le bouchon du bec verseur, puis retirer le film jointif.
- Etape 2 : Presser doucement le flacon pour remplir le doseur avec la quantité requise de liquide.
- Etape 3 : Verser ensuite directement le volume de liquide mesuré sur l'animal comme demandé.
- Répéter les étapes 2 et 3 pour les animaux suivants.
- Etape 4 : Remettre le bouchon après utilisation.
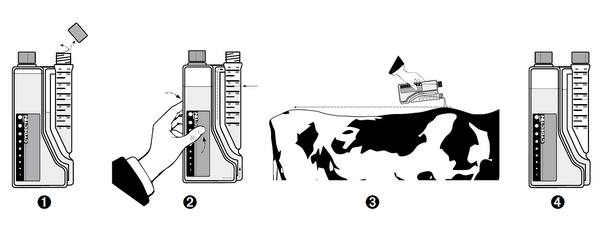
Instructions d'utilisation en utilisant un pistolet doseur (bidons de 2,5 et 5 litres) :
- Connecter le pistolet doseur en suivant les instructions suivantes :
- Attacher la partie ouverte du tuyau de prélèvement au bouchon avec l'embout.
- Remplacer le bouchon du bidon par le bouchon que vous venez de connecter au tuyau de prélèvement. Veiller à bien le resserrer.
- Armer doucement le pistolet doseur, vérifier que l'installation ne fuit pas.
Suivre les instructions du fabricant pour une utilisation et un entretien corrects de l'équipement.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Aucun signe de surdosage n'a été observé avec la spécialité après administration de 5 fois la dose recommandée. Cependant, si des effets secondaires survenaient, ils seraient en cohérence avec les symptômes de surdosage de la moxidectine, se manifestant sous forme d'hypersalivation transitoire, de dépression, de somnolence et d'ataxie. Le traitement n'est généralement pas nécessaire et le retour à la normale se produit dans les 24 à 48 heures. Il n'existe pas d'antidote spécifique.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Viande et abats : 143 jours.
Lait : ne pas utiliser chez les bovins de tous âges destinés à la production de lait de consommation humaine.
En raison de la possibilité importante de contamination croisée des animaux non traités par ce produit (léchage), les animaux traités doivent être logés séparément des animaux non traités pendant toute la durée du temps d'attente. Le non-respect de cette recommandation peut entrainer la présence de résidus chez les animaux non traités.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QP54AB52.
4.2 Propriétés pharmacodynamiques
La moxidectine est un antiparasitaire actif contre un large éventail de parasites internes et externes. Il s'agit d'une lactone macrocyclique de seconde génération de la famille des milbémycines. Elle agit principalement par interférence avec les canaux chlorure glutamate-dépendants ou les canaux GABA-dépendants (acide gamma amino butyrique) impliqués dans la transmission neuromusculaire. La moxidectine stimule la libération du GABA et accroît sa fixation aux récepteurs post-synaptiques, et se lie aux canaux chlore liés au glutamate. L'effet résultant est l'ouverture des canaux chlore de la jonction post-synaptique et l'entrée des ions chlore induisant un état de repos irréversible. Ceci provoque une paralysie flasque avec mort éventuelle des parasites exposés à la moxidectine.
Le triclabendazole est un douvicide qui appartient au sein des anthelminthiques à la classe des benzimidazoles. Il est établi que les benzimidazoles se lient sélectivement à la β-tubuline, entraînant la dépolymérisation des microtubules et l'interruption des processus impliquant ces microtubules chez les helminthes.
4.3 Propriétés pharmacocinétiques
La moxidectine diffuse à l'ensemble des tissus mais, en raison de sa liphophilie, les concentrations les plus importantes se trouvent dans la graisse. La moxidectine est métabolisée par hydroxylation. La seule voie d'excrétion significative est représentée par les fèces. Les paramètres pharmacocinétiques de la moxidectine administrée en pour-on dans la formulation finale de cette association sont les suivants : AUCtot; : 50,9 ng.d.mL-1, Cmax : 4,69 ng.mL-1, Tmax : 8,7 jours, temps de demi-vie plasmatique : 10,74 jours.
La majeure partie de la dose orale de triclabendazole chez les rats, les ovins, les caprins et les lapins est éliminée par les fèces en 6 à 10 jours, sous forme inchangée ou de produits d'excrétion biliaire. L'excrétion urinaire est minime. Les dérivés sulphone, sulphoxide, cétone et 4-hydroxy triclabendazole sont les principaux métabolites identifiés dans le plasma. Lors de l'administration orale de dérivés sulfone et sulfoxide dans différentes espèces, les études de cinétique plasmatiques ont montré que le dérivé sulfoxide était majoritaire chez les lapins, les moutons et les humains alors que le dérivé sulfone était prédominant chez les chevaux, chiens et bovins.
Lors de l'administration du triclabendazole dans la formulation finale de cette association, les principaux paramètres pharmacocinétiques du métabolite actif, le triclabendazole sulfoxide sont : AUCtot : 26,9 μg.h.mL-1, Cmax : 2,92 μg.mL-1, Tmax : 3,3 jours, temps de demi-vie plasmatique : 9,72 jours.
Lors de l'administration du triclabendazole dans la formulation finale, les principaux paramètres pharmacocinétiques du métabolite actif, le triclabendazole sulfone sont : AUCtot : 110,2 μ.h.mL-1, Cmax : 7,78 μg.mL-1, Tmax : 12,9 jours, temps de demi-vie plasmatique : 12,98 jours.
Propriétés environnementales
La moxidectine remplit les critères pour être qualifiée de substance (très) persistante, bioaccumulable et toxique (PBT). Plus particulièrement, dans des études sur la toxicité aiguë et chronique sur des algues, des crustacés et des poissons, la moxidectine a montré une toxicité pour ces organismes, donnant lieu aux résultats suivants:
| |||||||||||||||||||||||||||||
CE50: concentration qui entraîne des effets indésirables chez 50 % des animaux d’une espèce testée, à savoir la mortalité et les effets sublétaux.
CSEO: dans l’étude, concentration à laquelle aucun effet n’est observé.
Cela signifie que lorsque la moxidectine pénètre dans des organismes aquatiques, cela peut avoir une incidence grave et durable sur la vie aquatique. Afin d’atténuer ce risque, toutes les précautions d’emploi et d’élimination doivent être respectées.
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
En l'absence d'études de compatibilité, ne pas mélanger ce médicament vétérinaire avec d'autres médicaments vétérinaires.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
Durée de conservation après première ouverture du conditionnement primaire : 6 mois.
5.3 Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Protéger de la lumière.
Ne pas congeler.
En cas de congélation accidentelle, agiter vigoureusement avant utilisation.
5.4 Nature et composition du conditionnement primaire
Flacon polyéthylène haute densité
Bouchon polypropylène
Joint intérieur polyéthylène
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné. Le médicament vétérinaire ne doit pas contaminer les cours d'eau car la moxidectine peut être dangereuse pour les poissons et autres organismes aquatiques.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
ZOETIS FRANCE
10 RUE RAYMOND DAVID
92240 MALAKOFF
FRANCE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/0015587 8/2011
Boîte de 1 flacon doseur de 500 mL
Boîte de 1 flacon de 1 L
Boîte de 1 flacon de 2,5 L
Boîte de 1 flacon de 5 L
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
20/12/2011 - 28/09/2016
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
17/07/2023
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).