FATROSEAL SUSPENSION INTRAMAMMAIRE POUR VACHES AU TARISSEMENT
2. Composition qualitative et quantitative
Une seringue intramammaire de 4 g contient : |
|
|
|
Substance(s) active(s) : |
|
Bismuth lourd…………………………………………………….. | 1,858 g |
(sous forme de sous-nitrate) |
|
(soit 2,6 g de sous-nitrate de bismuth lourd) |
|
Pour la liste complète des excipients, voir la rubrique « Liste des excipients ».
3. Forme pharmaceutique
Suspension intramammaire
Suspension blanche à grisâtre, homogène.
4. Informations cliniques
4.1. Espèces cibles
Bovins (vaches laitières au tarissement)
4.2. Indications d'utilisation, en spécifiant les espèces cibles
Chez les bovins (vaches laitières au tarissement) :
Prévention de nouvelles infections intramammaires pendant toute la période de tarissement.
Chez les vaches ne présentant vraisemblablement pas de mammite subclinique, le médicament peut être utilisé seul dans le cadre d’un plan de gestion du troupeau au tarissement et de contrôle de mammites.
4.3. Contre-indications
Ne pas utiliser chez les vaches en lactation. Voir la rubrique « Utilisation en cas de gestation, la lactation ou de ponte ».
Ne pas utiliser le produit seul chez les vaches présentant une mammite subclinique au moment du tarissement.
Ne pas utiliser chez les vaches présentant une mammite clinique au moment du tarissement.
Ne pas utiliser en cas d’hypersensibilité au substance active ou à l’un des excipients.
4.4. Mises en garde particulières à chaque espèce cible
La sélection des vaches à traiter doit reposer sur le jugement clinique du vétérinaire. Les critères de sélection peuvent être fondés sur les antécédents de mammites et du nombre de cellules de chaque vache, ou sur des tests reconnus pour la détection des mammites subcliniques ou sur des prélèvements bactériologiques.
4.5. Précautions particulières d'emploi
i) Précautions particulières d'emploi chez l'animal
La surveillance régulière des signes de mammite clinique chez les vaches taries fait partie des bonnes pratiques d’élevage. Si une mammite clinique se déclare dans un quartier obturé, il est nécessaire de traire le quartier concerné avant d’instaurer un traitement approprié.
Pour réduire le risque de contamination, ne pas immerger la seringue dans l’eau. N’utiliser la seringue qu’une seule fois.
Le produit n’exerçant pas d’activité antimicrobienne, afin de minimiser le risque de mammite aiguë due à une mauvaise technique d’injection et à un manque d’hygiène (voir la rubrique « Effets indésirables (fréquence et gravité) »), il est crucial de suivre la technique d’administration aseptique décrite dans la rubrique « Posologie et voie d´administration ».
Ne pas administrer d’autre produit intramammaire après l’administration du produit. Chez les vaches susceptibles de présenter une mammite subclinique, le produit peut être utilisé après l’administration d’un traitement antibiotique approprié pour vaches taries dans le quartier infecté.
ii) Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Les sels de bismuth ont été associés à des réactions d’hypersensibilité.
Les personnes présentant une hypersensibilité (allergie) connue aux sels de bismuth doivent éviter tout contact avec le médicament vétérinaire.
Ce produit peut provoquer une irritation de la peau et des yeux. Éviter le contact avec la peau et les yeux.
En cas de contact avec la peau ou les yeux, laver soigneusement la zone concernée à l’eau. Si l’irritation persiste, demander un avis médical et montrer cette étiquette au médecin.
Si elles sont fournies, les lingettes de nettoyage peuvent provoquer une irritation de la peau et des yeux chez certaines personnes en raison de la présence d’alcool isopropylique et de digluconate de chlorhexidine. Éviter le contact avec la peau et les yeux.
Se laver les mains après utilisation.
iii) Autres précautions
Aucune.
4.6. Effets indésirables (fréquence et gravité)
Des mammites aiguës ont été très rarement signalées après l’utilisation de ce produit, principalement en raison d’une mauvaise technique d’injection et d’un manque d’hygiène. Voir les rubriques « Précautions particulières d’emploi » et « Posologie et voie d´administration » concernant l’importance de la technique aseptique.
La fréquence des effets indésirables est définie comme suit :
- très fréquent (effets indésirables chez plus d’1 animal sur 10 animaux traités)
- fréquent (entre 1 et 10 animaux sur 100 animaux traités)
- peu fréquent (entre 1 et 10 animaux sur 1 000 animaux traités)
- rare (entre 1 et 10 animaux sur 10 000 animaux traités)
- très rare (moins d’un animal sur 10 000 animaux traités, y compris les cas isolés).
4.7. Utilisation en cas de gestation, de lactation ou de ponte
Gestation :
Le produit n’est pas absorbé après une injection intramammaire, il peut être utilisé chez les animaux en gestation. Au moment du vêlage, le produit peut être ingéré par le veau. Cette ingestion est sans danger et n’entraîne pas d’effet indésirable.
Lactation :
Le produit est contre-indiqué pendant la lactation. En cas d’utilisation accidentelle chez une vache en lactation, une faible augmentation transitoire (jusqu’à 2 fois) du nombre de cellules somatiques peut être observée. Dans ce cas, retirer le bouchon de produit manuellement. Aucune autre précaution n’est nécessaire.
4.8. Interactions médicamenteuses et autres formes d'interactions
Dans les essais cliniques, la compatibilité d’une formulation comparable de produit intrammamaire contenant du sous-nitrate de bismuth n’a été démontrée qu’avec une préparation pour vaches taries contenant de la cloxacilline.
Voir également la rubrique « Précautions particulières d’emploi chez les animaux ».
4.9. Posologie et voie d'administration
Voie intramammaire uniquement.
Le produit est doté d’une tête à double embout. Le bouchon de la seringue peut être partiellement ou totalement retiré. Il est recommandé de pincer le trayon à la base pour faciliter le positionnement de la pâte dans le canal du trayon, en obturant le canal du trayon par le haut.
Embout court : L’embout court permet une insertion partielle, de sorte que la seringue ne doit être insérée que dans l’extrémité du trayon.
Embout long : L’embout long peut être utilisé pour faciliter le traitement, par exemple pour éviter que l’embout ne se retourne à cause d’une vache en mouvement ou nerveuse.
Étape 1 : Retrait du bouchon cassable
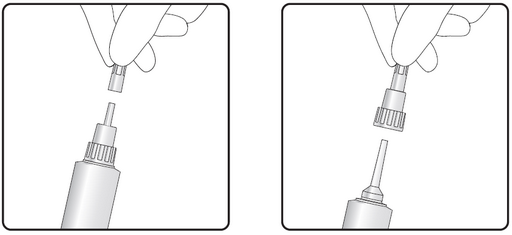
Étape 2 : Insertion d’un embout court ou long
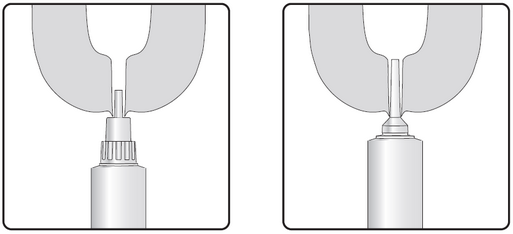
Injecter le contenu d’une seringue dans chaque trayon, immédiatement après la dernière traite au moment du tarissement. Ne pas masser le trayon ou la mamelle après l’injection du produit, car il est important que le produit reste dans le trayon lui-même et ne pénètre pas dans la mamelle.
Il faut veiller à ne pas introduire d’agents pathogènes dans le trayon afin de réduire le risque de mammite post-injection.
Il est essentiel que le trayon soit soigneusement nettoyé et désinfecté, avec de l’alcool chirurgical ou des lingettes imprégnées d’alcool. Les trayons doivent être essuyés jusqu’à ce que les lingettes ne soient plus visiblement sales. Les trayons doivent pouvoir sécher avant l’injection. Injecter le produit de manière aseptique et veiller à éviter toute contamination de l’embout de la seringue. Après l’injection, il est conseillé d’utiliser un produit de trempage des trayons ou un spray approprié.
Lorsqu’il fait froid, le produit peut être réchauffé à température ambiante dans un environnement chaud, pour faciliter l’utilisation de la seringue.
4.10. Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Le double de la dose recommandée a été administré à des vaches sans provoquer d’effets indésirables cliniques.
4.11. Temps d'attente
Viandes et abats : zéro jour.
Lait : zéro heure.
5. Propriétés pharmacologiques
Groupe pharmacothérapeutique : divers produits pour les trayons et la mamelle.
Code ATC-vet : QG52X
5.1. Propriétés pharmacodynamiques
L’administration du produit dans chaque quartier produit une barrière physique contre l’entrée des bactéries, réduisant ainsi le risque de nouvelles infections intramammaires pendant la période de tarissement.
5.2. Caractéristiques pharmacocinétiques
Le sous-nitrate de bismuth n’est pas absorbé par la glande mammaire, mais reste sous forme bouchon dans le trayon jusqu’à ce qu’il soit physiquement retiré (ce qui est démontré chez les vaches dont la période de tarissement peut atteindre 100 jours).
6. Informations pharmaceutiques
6.1. Liste des excipients
Stéarate d’aluminium
Silice colloïdale anhydre
Paraffine liquide
6.2. Incompatibilités majeures
Sans objet.
6.3. Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et composition du conditionnement primaire
Seringue intramammaire unidose LDPE
Bouchon LDPE
6.6. Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
7. Titulaire de l'autorisation de mise sur le marché
FATRO
VIA EMILIA, 285
40064 OZZANO DELL’EMILIA
ITALIE
8. Numéro(s) d'autorisation de mise sur le marché
FR/V/6891161 8/2022
Boîte de 24 seringues intramammaires de 4 g
Boîte de 60 seringues intramammaires de 4 g
Boîte de 120 seringues intramammaires de 4 g
Boîte de 24 seringues intramammaires de 4 g et 24 lingettes nettoyantes
Boîte de 60 seringues intramammaires de 4 g et 60 lingettes nettoyantes
Boîte de 120 seringues intramammaires de 4 g et 120 lingettes nettoyantes
Toutes les présentations peuvent ne pas être commercialisées.
9. Date de première autorisation/renouvellement de l'autorisation
14/03/2022
10. Date de mise à jour du texte
02/08/2022