FIPRONIL PYRIPROXYFENE VIRBAC 100 MG/120 MG SOLUTION POUR SPOT-ON POUR TRES GRANDS CHATS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Une pipette de 1 mL contient : |
|
|
|
Substance(s) active(s) : |
|
Fipronil ……………………………………. | 100 mg |
Pyriproxifène …………………………….. | 120 mg |
Excipient(s) :
Composition qualitative en excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Butylhydroxyanisole (E320) | 0,2 mg |
Butylhydroxytoluène (E321) | 0,1 mg |
Ether monoéthylique de diéthylèneglycol | / |
Solution limpide, incolore à jaune pâle.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chats.
3.2 Indications d'utilisation pour chaque espèce cible
Chez les chats, à utiliser contre les infestations par les puces seules ou les infestations mixtes par les puces et les tiques.
Puces :
Traitement et prévention des infestations par les puces (Ctenocephalides felis). Une application empêche toute nouvelle infestation pendant 5 semaines.
Prévention de la multiplication des puces pendant 12 semaines après application, en empêchant le développement des œufs en puces adultes.
Le médicament vétérinaire peut être intégré à une stratégie de traitement de la Dermatite par Allergie aux Piqûres de Puces (DAPP) quand cette affection a fait l’objet d’un diagnostic préalable par un chirurgien vétérinaire.
Tiques :
Traitement des infestations par les tiques (Ixodes ricinus et Rhipicephalus turanicus).
Après une application, l’efficacité acaricide persiste pendant une semaine.
Si des tiques sont présentes au moment de l’application, elles peuvent ne pas être toutes tuées dans les 48 heures.
3.3 Contre-indications
Ne pas utiliser chez le lapin puisque des effets indésirables et parfois même le décès peuvent survenir.
Ne pas utiliser en cas d’hypersensibilité aux substances actives ou à l’un des excipients.
3.4 Mises en garde particulières
L’utilisation inutile d’antiparasitaires ou une utilisation s’écartant des instructions données dans le RCP peut augmenter la pression de sélection de la résistance et entraîner une réduction de l’efficacité. La décision d’utiliser le produit doit se fonder sur la confirmation de l’espèce parasite et de la charge parasitaire, ou du risque d’infestation en fonction de ses caractéristiques épidémiologiques, pour chaque animal.
Deux études de laboratoire ont évalué l’efficacité du médicament vétérinaire lorsque le pelage est mouillé avec de l’eau 2 heures avant application du médicament vétérinaire et 2 fois au cours de la période d’efficacité du médicament vétérinaire contre les puces (à deux semaines d’intervalle contre les puces adultes ou à quatre semaines d’intervalle contre les stades immatures de puces). Mouiller le pelage dans les conditions décrites n’affecte pas l’efficacité du médicament vétérinaire.
L’effet d’un shampoing sur l’efficacité du médicament vétérinaire n’a pas été évalué. Si un shampoing s’avère nécessaire, il est recommandé de le faire avant application du médicament vétérinaire.
Dès le début des mesures de contrôle antiparasitaire, en cas d’infestation, le panier de l’animal et ses zones de couchage ou de repos comme les tapis et les canapés doivent être traités avec un insecticide approprié et passés régulièrement à l’aspirateur.
Pour réduire la pression parasitaire environnementale liée aux puces, il est recommandé de traiter tous les animaux du foyer avec un produit contre les puces approprié.
Le médicament vétérinaire n’empêche pas les tiques de se fixer. Si l’animal a été traité avant l’exposition aux tiques, ces dernières seront tuées dans les 48 heures après fixation. Cela précède généralement le gorgement, réduisant mais n’excluant pas le risque de transmission de maladies.
Une fois mortes, les tiques se détachent souvent de l’animal. Toute tique restante devra être retirée précautionneusement, en s’assurant que les pièces buccales ne restent pas dans la peau.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
A usage externe exclusivement. Ne pas administrer oralement.
Les animaux doivent être pesés avec précision avant le traitement.
L’innocuité de ce médicament vétérinaire n’a pas été établie chez les chats de moins de 10 semaines ou pesant moins de 1,0 kg.
Eviter tout contact avec les yeux de l’animal. Dans le cas d’un contact oculaire accidentel, nettoyer les yeux à l’eau.
Veiller à appliquer le médicament vétérinaire correctement tel que décrit dans la rubrique 3.9. Ne pas appliquer le médicament vétérinaire sur une plaie ou autre lésion cutanée. Il est important de s’assurer que le médicament vétérinaire est appliqué directement sur une zone de peau sèche que l’animal ne peut pas lécher et que les animaux ne se lèchent pas mutuellement après le traitement.
L’utilisation du médicament vétérinaire n’a pas été étudiée chez les animaux malades ou affaiblis. L’utilisation du médicament vétérinaire chez les animaux malades ou affaiblis ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire.
En l’absence d’études d’innocuité complémentaires, ne pas répéter le traitement à un intervalle de moins 4 semaines.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Le médicament vétérinaire peut occasionner des troubles nerveux. Il peut être toxique en cas d’ingestion.
Éviter l’ingestion y compris le contact main-bouche.
Ne pas fumer, boire ou manger pendant l’application du médicament vétérinaire.
En cas d’ingestion accidentelle, demander immédiatement conseil à un médecin et lui montrer la notice ou l’étiquette.
Ce médicament vétérinaire peut provoquer une irritation des yeux et des muqueuses.
Éviter tout contact avec la peau, les yeux et la bouche y compris le contact main-bouche.
En cas de contact avec la peau ou les yeux, rincer immédiatement et abondamment avec de l’eau. Si l’irritation cutanée ou oculaire persiste, consulter un médecin et lui présenter la notice ou l’emballage.
Se laver les mains soigneusement après utilisation.
Les animaux traités ne doivent pas être manipulés tant que le site d’application n’est pas sec et les enfants ne doivent pas être autorisés à jouer avec eux. Il est donc recommandé de traiter les animaux en début de soirée ou en fin d’après-midi pour réduire au maximum les contacts avec l’animal traité.
Le jour du traitement, les animaux traités ne doivent pas être autorisés à dormir avec leurs maîtres, en particulier les enfants. Conserver les pipettes dans leur emballage d’origine jusqu’à leur utilisation et éliminer les pipettes usagées.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
Le médicament vétérinaire peut avoir des effets indésirables sur les surfaces peintes ou vernies ou autres matériaux et meubles de la maison. Attendre que le site d’application soit sec avant de permettre le contact avec ces matériaux.
3.6 Effets indésirables
Chats :
Très rare ( < 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Réactions sur le site d’application : modification du pelage (aspect mouillé), desquamation, dermatose squameuse, alopécie, prurit, érythème, coloration anormale de la peau. Prurit, alopécie générale, hypersalivation. Hyperesthésie, dépression, nervosité.1 Signes respiratoires, vomissements. |
1 Symptômes neurologiques réversibles
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation :
Les études de laboratoire réalisées chez le chat avec le fipronil et le pyriproxifène n’ont mis en évidence aucun effet tératogène ou fœtoxique. L’innocuité du médicament vétérinaire n’a pas été établie chez la chatte en cas de gestation et de lactation. L’utilisation chez les chattes gestantes ou allaitantes ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
3.8 Interactions médicamenteuses et autres formes d'interactions
Aucune connue.
3.9 Voies d'administration et posologie
Spot-on.
Posologie :
Pour un chat pesant plus de 6 kg, appliquer une pipette de 1 mL, correspondant à la dose minimale recommandée de 8,3 mg de fipronil et 10 mg pyriproxifène par kg de poids corporel.
La dose recommandée de 1 mL peut être effectuée en appliquant 2 pipettes de 0,5 mL.
Un sous-dosage peut entraîner une utilisation inefficace et favoriser le développement d’une résistance.
Poids | Volume de la pipette | Fipronil (mg) | Pyriproxifène (mg) |
> 6-12 kg | 1 mL | 100 | 120 |
Mode d’administration :
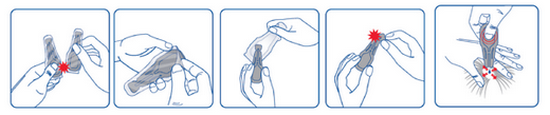
Extraire la pipette de la plaquette thermoformée. La tenir en position verticale. Tapoter la partie étroite de la pipette pour s’assurer que le contenu est bien descendu dans la partie centrale de la pipette. Rompre l’extrémité autocassable de la pipette en suivant la ligne gravée.
Ecarter les poils de l’animal à la base du cou, jusqu’à ce que la peau soit visible. Placer l’embout de la pipette directement sur la peau ainsi exposée. Presser doucement la partie centrale de la pipette plusieurs fois pour en expulser entièrement le contenu en un ou deux points. S’assurer que la solution est appliquée sur une peau saine. Eviter l’application superficielle sur le pelage du chat ou que la solution ne s’écoule, en particulier pour les grands chats (de plus de 6 kg).
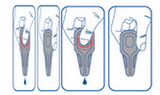
Système anti-goutte (le médicament vétérinaire est libéré uniquement par pression sur la partie centrale de la pipette).
Pour un contrôle optimal des infestations par les puces et les tiques et de la multiplication des puces, la fréquence d’application peut se baser sur les conditions épidémiologiques locales. Cependant, en l’absence d’études complémentaires, ne pas renouveler le traitement à intervalles de moins de 4 semaines (voir rubrique 3.10).
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Aucun effet indésirable grave n’a été observé au cours d’une étude d’innocuité réalisée sur des chatons de 10 semaines, traités avec jusqu’à 5 fois la dose maximale recommandée 3 fois à 4 semaines d’intervalle, et traités avec la dose maximale recommandée 6 fois à 4 semaines d’intervalle.
Le risque d’effets indésirables (voir rubrique 3.6) peut cependant augmenter avec le surdosage, il faut donc toujours traiter les animaux avec la taille de pipette adaptée à leur poids.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QP53AX65
4.2 Propriétés pharmacodynamiques
Le fipronil est un insecticide et un acaricide de la famille des phénylpyrazolés. Le fipronil et son métabolite, le fipronil sulfone, agissent sur les canaux chlorure activés par des ligands, en particulier les canaux activés par le neurotransmetteur acide gamma-aminobutyrique (GABA) mais aussi les canaux désensibilisants (D) et non-désensibilisants (N) activés par le glutamate (Glu, canaux chlorure ligand-dépendants propres aux Invertébrés). Ils bloquent ainsi le passage pré- et post-synaptique des ions chlorure à travers la membrane cellulaire. Il en résulte une activité incontrôlée du système nerveux central et la mort des insectes ou des acariens.
Le pyriproxifène est un inhibiteur de croissance des insectes (IGR) de la famille des analogues de l’hormone juvénile. Le pyriproxifène stérilise les puces adultes et inhibe le développement des stades immatures. La molécule empêche, par contact, l’émergence d’insectes adultes, en bloquant le développement des œufs (effet ovicide), des larves et des pupes (effet larvicide), qui sont ainsi éliminés. Elle agit également par contact et/ou ingestion par les puces adultes en stérilisant les œufs pendant leur maturation et avant la ponte. Enfin, la molécule empêche la contamination de l’environnement des animaux traités par les stades immatures des puces.
L’association du fipronil et du pyriproxifène présente une activité insecticide et acaricide contre les puces (Ctenocephalides felis) et les tiques (Rhipicephalus turanicus, Ixodes ricinus) et empêche le développement des œufs en puces adultes.
Une telle association procure un contrôle intégré des puces qui peut être utilisé lors d’infestations par les puces seules ou lors d’infestations mixtes par les puces et les tiques.
4.3 Propriétés pharmacocinétiques
Dans les conditions normales d’utilisation du médicament vétérinaire, le fipronil et le pyriproxifène sont correctement distribués dans le pelage de l’animal dès le premier jour suivant l’application topique. Le métabolite principal du fipronil est son dérivé sulfoné, qui possède également des propriétés insecticides et acaricides.
Les concentrations de fipronil et de pyriproxifène dans le pelage diminuent progressivement mais sont toujours détectables au moins 84 jours après application (c’est-à-dire au-dessus de la limite inférieure de quantification -LQ-qui est de 100 ng/g pour le fipronil et de 50 ng/g pour le pyriproxifène). Les concentrations de fipronil sulfone restent en dessous de la limite inférieure de quantification (LQ 100 ng/mL) après l’application du médicament vétérinaire.
Le pic de concentration plasmatique du fipronil et du pyriproxifène est rapidement atteint 1 jour après administration du médicament vétérinaire. Les concentrations de fipronil sont quantifiables chez tous les chats jusqu’à 3 jours après application (LQ 1 ng/mL). Les concentrations de pyriproxifène sont quantifiables chez tous les chats jusqu’à 42 jours après application (LQ 0,2 ng/mL). Les concentrations de fipronil sulfone restent en dessous de la limite inférieure de quantification (LQ 1 ng/mL) après l’application du médicament vétérinaire.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
Aucune connue.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
5.3 Précautions particulières de conservation
À conserver à une température ne dépassant pas 30 °C.
À conserver dans un endroit sec.
Conserver le conditionnement primaire dans l’emballage extérieur de façon à le protéger de la lumière.
5.4 Nature et composition du conditionnement primaire
Pipette unidose transparente de 1,0 mL, en plastique multicouche thermoformée (polyacrylonitrile méthacrylate ou polyéthylène - éthylène - alcool vinylique - polyéthylène, polypropylène/copolymère d’oléfines cycliques/polypropylène) et fermée par thermoscellage d’un film (polyacrylonitrile méthacrylate ou polyéthylène - éthylène - alcool vinylique - polyéthylène/aluminium/polyéthylène - téréphtalate).
Les boîtes contiennent une ou plusieurs pipettes individuelles placées dans des surblisters en polypropylène/copolymère d’oléfines cycliques/polypropylène et fermés par un film en polyéthylène téréphtalate/aluminium-polypropylène
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Le médicament vétérinaire ou l’emballage vide ne doit pas être déversé dans les cours d’eau car le fipronil et le pyriproxifène pourraient mettre les poissons et autres organismes aquatiques en danger.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
ALFAMED
13EME RUE LID
06517 CARROS CEDEX
FRANCE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/4883780 4/2023
Boîte de 4 pipettes
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
11/01/2024
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
11/01/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire non soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).