HALOFUSOL 0,5 MG/ML SOLUTION BUVABLE POUR VEAUX
2. Composition qualitative et quantitative
Un mL contient : |
|
|
|
Substance(s) active(s) : |
|
Halofuginone (sous forme de lactate) ………………... | 0,50 mg |
(équivalant à 0,6086 mg de lactate d’halofuginone) |
|
|
|
Excipient(s) : |
|
Acide benzoïque (E210) ……………………………..... | 1,00 mg |
Tartrazine (E102) ………………………………………. | 0,03 mg |
Pour la liste complète des excipients, voir rubrique « Liste des excipients ».
3. Forme pharmaceutique
Solution buvable de couleur jaune clair.
4. Informations cliniques
4.1. Espèces cibles
Bovins (Veaux nouveaux-nés).
4.2. Indications d'utilisation, en spécifiant les espèces cibles
Chez les veaux nouveaux-nés :
- Prévention de la diarrhée due à une infection à Cryptosporidium parvum diagnostiquée dans les élevages ayant un historique de cryptosporidiose.
Le traitement doit être instauré dans les premières 24 à 48 heures suivant la naissance.
- Réduction de la diarrhée due à une infection à Cryptosporidium parvum diagnostiqué.
Le traitement doit être instauré dans les 24 heures suivant l'apparition de la diarrhée.
Dans les deux cas, la réduction de l'excrétion d'oocystes a été démontrée.
4.3. Contre-indications
Ne pas administrer aux animaux dont l'estomac est vide.
Ne pas utiliser en cas de diarrhée installée depuis plus de 24 heures et chez les animaux faibles.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à un des excipients.
4.4. Mises en garde particulières à chaque espèce cible
Aucune.
4.5. Précautions particulières d'emploi
i) Précautions particulières d'emploi chez l'animal
Administrer uniquement après le repas de colostrum, de lait ou de lactoremplaceur en utilisant la pompe doseuse fournie ou un dispositif approprié pour l’administration orale.
Ne pas administrer aux animaux dont l'estomac est vide. Pour traiter les veaux anorexiques, le produit doit être administré dans un demi-litre de solution électrolytique. Les animaux doivent recevoir suffisamment de colostrum conformément aux bonnes pratiques d’élevage.
ii) Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Les personnes présentant une hypersensibilité connue à la substance active ou à un des excipients doivent administrer le produit avec précautions.
Un contact répété avec le produit peut provoquer des allergies cutanées.
Eviter le contact avec la peau ou les yeux.
En cas de contact avec la peau et les yeux, rincer soigneusement la zone exposée à l’eau claire. Si une irritation oculaire persiste, consulter un médecin.
Porter des gants de protection lors de la manipulation du produit.
Se laver les mains après utilisation.
iii) Autres précautions
Aucune.
4.6. Effets indésirables (fréquence et gravité)
Dans de très rares cas une augmentation de la sévérité de la diarrhée a été observée chez les animaux traités.
La fréquence des effets indésirables est définie comme suit :
- très fréquent (effets indésirables chez plus d’1 animal sur 10 animaux traités)
- fréquent (entre 1 et 10 animaux sur 100 animaux traités)
- peu fréquent (entre 1 et 10 animaux sur 1 000 animaux traités)
- rare (entre 1 et 10 animaux sur 10 000 animaux traités)
- très rare (moins d’un animal sur 10 000 animaux traités, y compris les cas isolés).
4.7. Utilisation en cas de gestation, de lactation ou de ponte
Sans objet.
4.8. Interactions médicamenteuses et autres formes d'interactions
Aucune connue.
4.9. Posologie et voie d'administration
Administration par voie orale chez les veaux après le repas.
La posologie est : 100 μg d’halofuginone base par kg de poids vif (PV), une fois par jour pendant 7 jours consécutifs, soit 4 mL de produit pour 20 kg PV, une fois par jour pendant 7 jours consécutifs.
Cependant, afin de faciliter le traitement par le produit, un schéma posologique simplifié est proposé :
• 35 kg < veaux ≤ 45 kg : 8 mL de produit, 1 fois par jour pendant 7 jours consécutifs.
• 45 kg < veaux < 60 kg : 12 mL de produit, 1 fois par jour pendant 7 jours consécutifs.
Pour les poids plus faibles ou plus élevés, un calcul précis de la dose doit être effectué (4 mL/20 kg PV).
Pour assurer une posologie correcte, l’utilisation de la pompe doseuse fournie ou d’un dispositif approprié à l'administration orale est nécessaire.
Dans le cas d’une utilisation de la pompe doseuse fournie, ne pas l’utiliser tête en bas, mais comme décrit ci-après :
1) Visser la pompe sur le flacon.
2) Enlever le capuchon protecteur de l’embout.
3) Si la pompe doseuse est utilisée pour la première fois (ou si elle n’a pas été utilisée depuis plusieurs jours) pomper soigneusement jusqu’à ce qu’une goutte de produit se forme à l’extrémité de l’embout.
4) Immobiliser le veau et introduire l’embout de la pompe doseuse dans la bouche.
5) Appuyer sur la poignée de la pompe doseuse à fond pour délivrer une dose de 4 mL de solution. Appuyer deux ou trois fois, respectivement, pour administrer le volume désiré (8 mL pour un veau de 35 – 45 kg et 12 mL pour un veau de 45 – 60 kg, respectivement).
6) Dévisser la pompe sur le flacon.
7) Refermer la bouteille en revissant le bouchon.
8) Pomper deux ou trois fois pour éliminer le produit restant dans la pompe doseuse.
9) Remettre le capuchon protecteur sur l’embout.
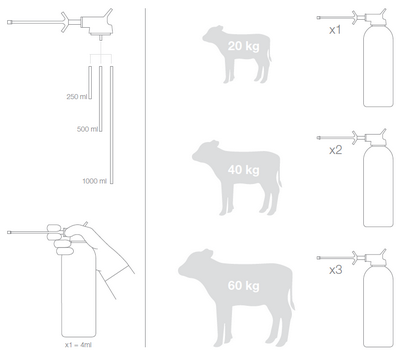
Les administrations consécutives doivent être effectuées au même moment de la journée.
Dès qu'un premier veau a été traité, tous les veaux nouveau-nés à venir doivent être systématiquement traités aussi longtemps que le risque de diarrhées dues à C. parvum persiste.
4.10. Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Des symptômes de toxicité pouvant apparaître à 2 fois la dose thérapeutique, il est nécessaire d’appliquer strictement la dose recommandée. Les symptômes de toxicité incluent diarrhée, présence de sang visible dans les fèces, diminution de la consommation de lait, déshydratation, apathie et prostration. Si des signes cliniques de surdosage apparaissent, le traitement doit être interrompu immédiatement et l’animal nourri avec du lait non médicamenté ou du lactoremplaceur. Une réhydratation peut être nécessaire.
4.11. Temps d'attente
Viande et abats : 13 jours.
5. Propriétés pharmacologiques
Groupe pharmacothérapeutique : autres agents antiprotozoaires, halofuginone
Code ATC-vet : QP51AX08.
5.1. Propriétés pharmacodynamiques
Le principe actif, l’halofuginone, est un antiprotozoaire du groupe des dérivés de la quinazolinone (polyhétérocycles azotés). Le lactate d’halofuginone (RU 38788) est un sel dont les propriétés antiprotozoaires et l’efficacité contre Cryptosporidium parvum ont été démontrées dans les conditions in vitro ainsi qu’au cours d’infections artificielles et naturelles. Le produit a un effet crytosporidiostatique sur Cryptosporidium parvum. Il est principalement actif sur les stades libres du parasite (sporozoïte, mérozoïte). Les concentrations inhibant 50 % et 90 % des parasites dans les essais in vitro sont respectivement inférieures à 0,1 μg/mL pour la CI50 et égale à 4,5 μg/mL pour la CI90.
5.2. Caractéristiques pharmacocinétiques
La biodisponibilité du produit chez le veau après une seule administration orale est d'environ 80 %. Le temps nécessaire pour obtenir la concentration maximale Tmax est de 11 heures. La concentration maximale dans le plasma, Cmax, est de 4 ng/mL. Le volume de distribution apparent est 10 L/kg. Les concentrations plasmatiques d’halofuginone obtenues après administrations orales répétées sont comparables au profil pharmacocinétique obtenu après administration orale unique. L’halofuginone sous forme inchangée est le principal composant dans les tissus. Les valeurs les plus élevées ont été trouvées dans le foie et les reins. Le produit est principalement excrété dans l’urine. La demi-vie d’élimination terminale est de 11,7 heures après administration par voie intraveineuse et de 30,84 heures après une seule administration orale.
6. Informations pharmaceutiques
6.1. Liste des excipients
Acide benzoïque (E 210)
Tartrazine (E 102)
Acide lactique (E 270)
Eau purifiée
6.2. Incompatibilités majeures
En l’absence d’études de compatibilité, ce médicament vétérinaires ne doit pas être mélangé à d’autres médicaments vétérinaires.
6.3. Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 30 mois.
Durée de conservation après première ouverture du conditionnement : 6 mois.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et composition du conditionnement primaire
Flacon polyéthylène haute densité blanc
Bouchon à vis polyéthylène haute densité
Le médicament peut être livré avec ou sans la pompe doseuse qui est constituée de divers composants à base de polyéthylène basse densité, polypropylène, acier inoxydable et silicone.
6.6. Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Le produit ne doit pas être déversé dans les cours d’eau car cela pourrait mettre en danger les poissons et autres organismes aquatiques.
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régis par la réglementation sur les déchets.
7. Titulaire de l'autorisation de mise sur le marché
KARIZOO
C/, MAS PUJADES
11-12 POLIGONO INDUSTRIALE LA BORDA
08140 CALDES DE MONTBUI
ESPAGNE
8. Numéro(s) d'autorisation de mise sur le marché
FR/V/7948352 8/2020
Flacon de 250 mL
Boîte de 1 flacon de 250 mL avec une pompe doseuse de 4 mL
Boîte de 1 flacon de 250 mL
Flacon de 500 mL
Boîte de 1 flacon de 500 mL avec une pompe doseuse de 4 mL
Boîte de 1 flacon de 500 mL
Flacon de 1000 mL
Boîte de 1 flacon de 1000 mL avec une pompe doseuse de 4 mL
Boîte de 1 flacon de 1000 mL
Toutes les présentations peuvent ne pas être commercialisées.
9. Date de première autorisation/renouvellement de l'autorisation
20/04/2020
10. Date de mise à jour du texte
20/04/2020