METROBACTIN 500 MG COMPRIMES POUR CHIENS ET CHATS
2. Composition qualitative et quantitative
Un comprimé contient : |
|
|
|
Substance(s) active(s) : |
|
Métronidazole ……………………………………… | 500 mg |
Pour la liste complète des excipients, voir rubrique «Liste des excipients».
3. Forme pharmaceutique
Comprimé.
Comprimé brun clair tacheté de brun, rond et convexe, aromatisé, avec une barre de sécabilité en croix sur une face.
Les comprimés peuvent être divisés en 2 ou 4 parties égales.
4. Informations cliniques
4.1. Espèces cibles
Chiens et chats.
4.2. Indications d'utilisation, en spécifiant les espèces cibles
Chez les chiens et les chats :
- Traitement des infections gastro-intestinales dues à Giardia spp. et Clostridium spp. (c'est-à-dire C. perfringens ou C. difficile).
- Traitement des infections de l’appareil urogénital, de la cavité buccale, de la gorge et de la peau due aux bactéries anaérobies strictes (par exemple, Clostridium spp.) sensibles au métronidazole.
4.3. Contre-indications
Ne pas utiliser en cas de de troubles hépatiques.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
4.4. Mises en garde particulières à chaque espèce cible
Aucune.
4.5. Précautions particulières d'emploi
i) Précautions particulières d'emploi chez l'animal
En raison de la probable variabilité (temporelle et géographique) de la survenue de résistances bactériennes au métronidazole, un échantillonnage bactériologique et un test de sensibilité sont recommandés.
Dans la mesure du possible, le produit devra être utilisé uniquement sur la base d’un test de sensibilité.
Les politiques officielles, nationales et régionales, en matière d’utilisation des antibiotiques doivent être prises en compte lorsque le médicament vétérinaire est utilisé.
Les comprimés sont aromatisés. Conserver les comprimés hors de portée des animaux pour éviter toute ingestion accidentelle.
En particulier à la suite d’un traitement prolongé par le métronidazole des signes neurologiques peuvent apparaître.
ii) Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Le métronidazole présente des propriétés mutagènes et génotoxiques confirmées chez les animaux de laboratoire ainsi que chez l’être humain. Le métronidazole est un cancérogène confirmé chez les animaux de laboratoire et pourrait avoir des effets cancérigènes chez l’être humain. Toutefois, les données concernant la cancérogénicité du métronidazole chez l’être humain sont insuffisantes.
Le métronidazole peut être nocif pour le fœtus.
Eviter tout contact avec la peau ou les muqueuses, dont le contact main-bouche.
Pour cela, porter des gants imperméables lors de la manipulation des comprimés et/ou au moment de l’administration dans la gueule de l’animal.
Ne pas laisser les animaux lécher des personnes immédiatement après la prise du médicament.
En cas de contact cutané, laver soigneusement la zone concernée.
Afin d’éviter toute ingestion accidentelle, en particulier par un enfant, les fractions de comprimés non utilisées doivent être replacées dans l’alvéole ouverte de la plaquette et remises dans la boîte, gardée hors de vue et de portée des enfants.
La fraction de comprimée restante doit être utilisée lors de l’administration suivante.
En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette. Se laver soigneusement les mains après utilisation.
Le métronidazole peut provoquer des réactions d’hypersensibilité. En cas l’hypersensibilité connue au métronidazole, évitez tout contact avec le médicament vétérinaire.
iii) Autres précautions
Aucune.
4.6. Effets indésirables (fréquence et gravité)
Les effets indésirables suivants peuvent survenir après administration de métronidazole : vomissements, hépatotoxicité, neutropénie. Dans de très rares cas, des signes neurologiques peuvent survenir.
La fréquence des effets indésirables est définie comme suit :
- très fréquent (effets indésirables chez plus d’1 animal sur 10 animaux traités)
- fréquent (entre 1 et 10 animaux sur 100 animaux traités)
- peu fréquent (entre 1 et 10 animaux sur 1 000 animaux traités)
- rare (entre 1 et 10 animaux sur 10 000 animaux traités)
- très rare (moins d’un animal sur 10 000 animaux traités, y compris les cas isolés).
4.7. Utilisation en cas de gestation, de lactation ou de ponte
Les études chez les animaux de laboratoire ont donné des résultats contradictoires concernant les effets tératogènes/embryotoxiques du métronidazole. Par conséquent, l’utilisation de ce produit n’est pas recommandée durant la gestation. Le métronidazole est excrété dans le lait et son utilisation durant la lactation n’est donc pas recommandée.
4.8. Interactions médicamenteuses et autres formes d'interactions
Le métronidazole peut avoir un effet inhibiteur sur la dégradation de certains autres médicaments dans le foie, tels que la phénytoïne, la ciclosporine et la warfarine.
La cimétidine peut réduire le métabolisme hépatique du métronidazole, aboutissant à une augmentation des concentrations sériques du métronidazole.
Le phénobarbital peut augmenter le métabolisme hépatique du métronidazole, aboutissant à une réduction des concentrations sériques du métronidazole.
4.9. Posologie et voie d'administration
Voie orale.
La dose recommandée est de 50 mg de métronidazole par kg de poids corporel par jour, pendant 5 à 7 jours. La dose quotidienne peut être répartie à égalité sur deux prises quotidiennes (c'est-à-dire 25 mg de métronidazole par kg de poids corporel deux fois par jour).
Pour s’assurer que la dose administrée est correcte, le poids corporel de l'animal doit être déterminé aussi précisément que possible.
Les comprimés peuvent être divisés en 2 ou 4 parties égales pour obtenir l’exacte posologie nécessaire. Placez le comprimé sur une surface plate, avec la face portant la barre de sécabilité tournée vers le haut et la face convexe (arrondie) tournée vers le plan de travail.
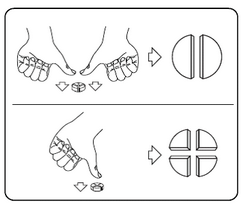
Moitiés : appuyez avec vos pouces des deux côtés du comprimé.
Quarts : appuyez avec votre pouce au centre du comprimé.
4.10. Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Le risque de survenue d’effets indésirables est plus important en cas de traitement à des doses et sur des durées supérieures à celles recommandées. Si des signes neurologiques apparaissent, le traitement doit être interrompu et une prise en charge symptomatique doit être instaurée.
4.11. Temps d'attente
Sans objet.
5. Propriétés pharmacologiques
Groupe pharmacothérapeutique : Antiprotozoaires contre les maladies à protozoaires, dérivés du (nitro)-imidazole.
Code ATC-vet : QP51AA01
5.1. Propriétés pharmacodynamiques
Une fois que le métronidazole a pénétré la bactérie, la molécule est réduite par la bactérie (anaérobie) sensible. Les métabolites ainsi créés exercent un effet toxique sur la bactérie en se liant à l’ADN bactérien. En général, le métronidazole a une action bactéricide sur les bactéries sensibles à des concentrations égales ou légèrement supérieures à la concentration minimale inhibitrice (CMI).
D’un point de vue clinique, le métronidazole n’a pas d’effet significatif sur les bactéries anaérobies facultatives, aérobies strictes et microaérophiles.
5.2. Caractéristiques pharmacocinétiques
Le métronidazole est immédiatement et bien absorbé après administration orale. Au bout d’une heure, une concentration plasmatique de 10 µg/ml a été atteinte lors de l’administration d’une dose unique de 50 mg. La biodisponibilité du métronidazole est proche de 100 % et sa demi-vie plasmatique est d’environ 8 à 10 heures. Le métronidazole a une bonne pénétration dans les tissus et les fluides corporels tels que la salive, le lait, les sécrétions vaginales et le sperme. Le métronidazole est métabolisé principalement dans le foie. Dans les 24 heures suivant l’administration orale, 35 % à 65 % de la dose administrée sont excrétés (sous forme de métronidazole et de ses métabolites) dans l’urine.
6. Informations pharmaceutiques
6.1. Liste des excipients
Cellulose microcristalline
Carboxyméthylamidon sodique de type A
Hydroxypropylcellulose
Levure de bière
Arôme poulet
Stéarate de magnésium
6.2. Incompatibilités majeures
Sans objet.
6.3. Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
Durée de conservation des fractions de comprimé : 3 jours.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et composition du conditionnement primaire
Plaquette thermoformée PVDC / polyéthylène / PVC - aluminium
6.6. Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
7. Titulaire de l'autorisation de mise sur le marché
DECHRA REGULATORY
HANDELSWEG 25
5531 AE BLADEL
PAYS-BAS
8. Numéro(s) d'autorisation de mise sur le marché
FR/V/2612803 2/2015
Boîte de 1 plaquette thermoformée de 10 comprimés quadrisécables
Boîte de 2 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 3 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 4 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 5 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 6 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 7 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 8 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 9 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 10 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 25 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 50 plaquettes thermoformées de 10 comprimés quadrisécables
Toutes les présentations peuvent ne pas être commercialisées.
9. Date de première autorisation/renouvellement de l'autorisation
15/10/2015 - 09/11/2020
10. Date de mise à jour du texte
02/05/2022