MOXODEX LA 100 MG/ML SOLUTION INJECTABLE POUR BOVINS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque mL contient : |
|
|
|
Substance(s) active(s) : |
|
Moxidectine ……………………………………........... | 100 mg |
|
|
Excipient(s) : |
|
|
|
Composition qualitative des excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Alcool benzylique (E1519) | 70 mg |
Butylhydroxytoluène (E321) | ≤ 0,6 mg |
Oléate de sorbitan | / |
Dicaprylate/dicaprate de propylène glycol | / |
Solution injectable transparente, jaune, pratiquement exempte de particules visibles.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Bovins.
3.2 Indications d'utilisation pour chaque espèce cible
Chez les bovins pesant 100 à 500 kg de poids vif, traitement et prévention des infestations mixtes par les nématodes gastro-intestinaux et pulmonaires suivants, ainsi que par certains parasites arthropodes :
Nématodes gastro-intestinaux adultes et immatures :
. Haemonchus placei
. Haemonchus contortus
. Ostertagia ostertagi (y compris les larves inhibées)
. Trichostrongylus axei
. Trichostrongylus colubriformis
. Nematodirus helvetianus (adultes uniquement)
. Nematodirus spathiger
. Cooperia surnabada
. Cooperia oncophora
. Cooperia pectinata
. Cooperia punctata
. Oesophagostomum radiatum
. Bunostomum phlebotomum (adultes uniquement)
. Chabertia ovina (adultes uniquement)
. Trichuris spp. (adultes uniquement)
Nématodes de l’appareil respiratoire adultes et immatures :
. Dictyocaulus viviparus
Larves du varron (larves migratrices) :
. Hypoderma bovis
. Hypoderma lineatum
Poux :
. Linognathus vituli
. Haematopinus eurysternus
. Solenopotes capillatus
. Bovicolabovis (aide au contrôle)
Acariens :
. Sarcoptes scabiei
. Psoroptes ovis
. Chorioptes bovis (aide au contrôle)
Le produit est doté d’une action persistante et protège les bovins un certain temps des infections ou réinfections par les parasites suivants pendant la période indiquée :
Espèces | Période de protection (jours) |
Dictyocaulus viviparus | 120 |
Ostertagia ostertagi | 120 |
Haemonchus placei | 90 |
Oesophagostomum radiatum | 150 |
Trichostrongylus axei | 90 |
Linognathus vituli | 133 |
Le produit est efficace contre les larves d’Hypoderma au moment du traitement mais la persistance de son activité contre les Hypoderma n’a pas été évaluée. Si le produit est administré avant la fin de la saison des mouches, il pourrait s’avérer nécessaire d’administrer un traitement complémentaire à l’aide d’un produit efficace contre Hypoderma.
Les périodes de persistance de l’efficacité ont été établies uniquement pour les espèces de parasites répertoriées dans la liste ci-dessus. Une réinfection reste donc possible chez les animaux au pâturage contaminés par d’autres parasites que ceux-ci avant la fin des 90 jours de persistance minimum démontrée pour des espèces spécifiques.
3.3 Contre-indications
Ne pas administrer à des animaux pesant moins de 100 kg ou plus de 500 kg.
Ne pas injecter le produit par voie intravasculaire. Une injection intravasculaire pourrait entraîner une ataxie, une paralysie, des convulsions, un collapsus et le décès. Afin d’éviter toute injection intravasculaire, suivre attentivement la procédure d’administration décrite à la rubrique « Voies d’administration et posologie ».
Ne pas administrer en cas d’hypersensibilité à la substance active ou à l’un des excipients.
3.4 Mises en garde particulières
L’utilisation non nécessaire d’antiparasitaires ou leur administration en dehors des consignes figurant dans le RCP peut accroître la pression de sélection de la résistance et entraîner une réduction de l’efficacité. La décision d’administrer le médicament vétérinaire doit être basée sur la confirmation des espèces de parasites et de la charge qu’ils représentent, ou du risque d’infestation à partir de ses caractéristiques épidémiologiques, pour chaque groupe d’animaux.
Une utilisation répétée pendant une période prolongée, surtout si l’on administre la même classe de substances, accroît le risque d’apparition d’une résistance. Au sein d’un groupe d’animaux, il est essentiel de conserver des refuges afin de réduire ce risque. Il faut éviter d’appliquer à l’ensemble d’un groupe d’animaux le traitement de façon systématique et régulière. Au contraire, si cela est possible, traiter uniquement certains animaux en particulier ou des sous-groupes (traitement sélectif ciblé). Des mesures adéquates de gestion du bétail et des pâtures doivent y être associées. Des directives pour chaque groupe d’animaux pourront être données par le vétérinaire responsable.
Le sous-dosage, qui peut être dû à une sous-estimation du poids vif ou à une mauvaise administration du médicament vétérinaire, peut rendre l’administration inefficace et favoriser l’apparition d’une résistance.
Les cas cliniques avec suspicion de résistance aux anthelminthiques doivent faire l’objet d’un examen plus approfondi à l'aide de tests adéquats (par ex. : test de réduction d’excrétion fécale des œufs). Lorsque les résultats du/des test(s) suggère(nt) fortement une résistance à un anthelminthique particulier, il faut utiliser un anthelminthique appartenant à une autre classe pharmacologique et ayant un mode d'action différent.
En l’absence de risques de co-infection, Il est possible d’administrer un produit à spectre étroit.
Une résistance croisée partielle entre l’ivermectine et la moxidectine a été signalée chez des nématodes. Des cas de résistance à la moxidectine ont été signalés pour les genres Cooperia, Ostertagia, Oesophagostomum et Trichuris de nématodes gastro-intestinaux des bovins, et pour les acariens du type Psoroptes, dans l’UE et ailleurs.
L’utilisation de ce produit doit tenir compte des informations locales concernant la sensibilité des parasites ciblés, lorsqu’on en dispose.
Toute résistance confirmée doit être signalée au titulaire de l’autorisation de mise sur le marché ou à l’autorité nationale compétente.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Afin de prévenir les abcès, il est recommandé d’utiliser une technique aseptique stricte. Le médicament vétérinaire a été formulé spécifiquement en vue d’une injection sous-cutanée au niveau de la surface dorsale de l’oreille des bovins ; il ne doit pas être administré par une autre voie ou à d’autres espèces.
Afin d’éviter d’éventuelles réactions secondaires dues à la mort de larves d’Hypoderma dans le rachis ou l’œsophage des animaux, il est recommandé d’administrer un médicament vétérinaire efficace contre les larves d’Hypoderma une fois la période d’activité des mouches terminée et avant que les larves n’atteignent leurs sites de repos. Demandez à votre vétérinaire de vous indiquer le moment propice pour effectuer le traitement.
L’immunisation contre les nématodes varie en fonction de l’exposition à l’infection. Bien que cela ne soit normalement pas le cas, il peut arriver que des mesures de lutte contre les vers parasites accentuent la vulnérabilité des bovins à la réinfection. Les animaux peuvent être exposés jusqu’à la fin de leur première saison de pâturage, surtout si celle-ci est longue, ou au cours de l’année suivante s’ils sont mis dans un pré hautement contaminé. Dans de tels cas, d’autres mesures de lutte pourraient s’avérer nécessaires.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
La moxidectine ou l’alcool benzylique peuvent provoquer une hypersensibilité (réactions allergiques). Les personnes présentant une hypersensibilité connue à la moxidectine ou à l’alcool benzylique doivent éviter tout contact avec le médicament vétérinaire.
Le médicament vétérinaire peut provoquer des irritations cutanées et oculaires. Éviter tout contact direct avec la peau et les yeux. Si une irritation cutanée ou oculaire apparaît, laver abondamment à eau.
Se laver les mains après utilisation.
Ne pas fumer, boire ou manger pendant la manipulation du médicament vétérinaire.
Bien veiller à ne pas s’auto-injecter le produit. En cas d’auto-injection accidentelle, consulter un médecin.
Conseil à l’intention des soignants en cas d’auto-injection accidentelle : traiter de façon symptomatique.
Précautions particulières concernant la protection de l'environnement
La moxidectine remplit les critères d'une substance (très) persistante, bioaccumulable et toxique (PBT) ; l'exposition de l'environnement à la moxidectine doit donc, dans la mesure du possible, être limitée. Les traitements doivent être administrés uniquement lorsque cela est nécessaire et doivent être basés sur le nombre d'œufs dans les fèces ou sur l'évaluation du risque d'infestation au niveau de l'animal et / ou du groupe d’animaux.
À l’instar des autres lactones macrocycliques, la moxidectine peut être nocive pour les organismes non cibles :
Les fèces contenant de la moxidectine excrétées dans les pâturages par des animaux traités peuvent réduire temporairement l'abondance des organismes se nourrissant de fumier. Suite au traitement des bovins avec le produit, des niveaux de moxidectine potentiellement toxiques pour les espèces de mouches du fumier peuvent être excrétés sur une période de plus de 4 semaines et diminuer l'abondance des mouches du fumier pendant cette période. Des tests en laboratoire ont démontré que la moxidectine peut temporairement affecter la reproduction des bousiers ; cependant, des études de terrain n'indiquent aucun effet à long terme. Cependant, en cas de traitements répétés par moxidectine (tout comme avec les médicaments vétérinaires de la même classe anthelminthique), il est conseillé de ne pas traiter à chaque fois les animaux sur le même pâturage afin de permettre aux populations de bousiers de se reconstituer.
La moxidectine est intrinsèquement toxique pour les organismes aquatiques, y compris les poissons. Le médicament vétérinaire doit être utilisé uniquement conformément aux instructions figurant sur l’étiquette. D’après le profil d’excrétion de la moxidectine lorsqu’elle est administrée sous forme de formulation injectable, les animaux traités ne doivent pas pouvoir accéder aux cours d’eau au cours des 10 jours suivant le traitement.
Autres précautions
3.6 Effets indésirables
Bovins :
Rare (1 à 10 animaux / 10 000 animaux traités) : | Gonflement au site d’injection1 Abattement et ataxie |
Fréquence indéterminée (ne peut être estimée à partir des données disponibles) : | Réaction d’hypersensibilité2 |
1 Gonflements immédiats ou différés. Ils peuvent ensuite se transformer en abcès (env. 1% des cas). La fréquence des gonflements au site d’injection a tendance à augmenter chez les animaux les plus lourds. Ces effets secondaires disparaissent généralement sans traitement dans un délai de 14 jours après l’administration, mais certains peuvent persister jusqu’à 5 semaines chez un certain nombre d’animaux (< 5 %), voire durer plus longtemps dans de très rares cas.
2En présence d’une réaction d’hypersensibilité, prodiguer un traitement symptomatique.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la rubrique « Coordonnées » de la notice.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation :
Peut être utilisé au cours de la gestation.
Lactation :
Sans objet. Cf. rubrique « Temps d’attente ».
3.8 Interactions médicamenteuses et autres formes d'interactions
La moxidectine augmente les effets des agonistes du GABA.
3.9 Voies d'administration et posologie
Voie sous-cutanée.
La posologie est la suivante : 0,5 mL/50 kg de poids vif, équivalant à 1,0 mg de moxidectine/kg de poids vif, administré en une unique injection sous-cutanée dans l’oreille à l’aide d’une seringue hypodermique 18 G de 25 à 40 mm. Il ne faut pas percer les dispositifs d’obturation du flacon de 50 mL plus de 20 fois et le flacon de 250 mL ne doit pas être percé plus de 5 fois. Utiliser une seringue automatique avec le flacon de 250 mL.
Bien agiter avant utilisation.
Afin de garantir l’administration de la dose correcte, il faut déterminer le poids aussi précisément que possible ; la dose doit être mesurée avec précision.
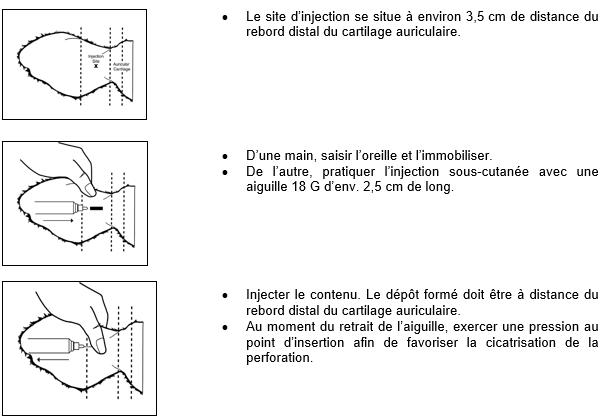
Il faut pratiquer l’injection par voie sous-cutanée dans les tissus mous de la surface dorsale de l’oreille, à distance du rebord distal du cartilage auriculaire.
Dans un premier temps, nettoyer la surface dorsale (externe) de l’oreille à l’aide d’un antiseptique puis laisser sécher rapidement à l’air. Palper le rebord du cartilage auriculaire situé le plus près de la tête, sur la surface dorsale (poilue) de l’oreille. À partir de ce point de repère, en prenant soin d’éviter les vaisseaux sanguins (artères, veines), il faut insérer l’aiguille en sous-cutané, en commençant à un point situé à environ 3 à 3,5 cm de ce rebord (à distance de la tête), en la dirigeant vers la base de l’oreille, l’aiguille enfoncée jusqu’à la garde. À ce moment-là, aspirer légèrement pour s’assurer que l’aiguille n’est pas dans un vaisseau sanguin.
Au moment de l’injection, le dépôt formé doit se situer à distance du rebord distal du cartilage auriculaire.
Après l’administration, retirer l’aiguille de la peau en exerçant une pression pendant plusieurs secondes avec le pouce sur le point d’insertion.
Etant donné la durée d'efficacité prolongée contre Dictyocaulus viviparus et les vers de l’estomac, Ostertagia ostertagi et Haemonchus placei, un traitement unique à contenant cette formulation, lors de la remise au pré, contribue au contrôle de la bronchite vermineuse (vers des bronches) et de la gastro-entérite parasitaire tout au long de la période de pâturage ; ce en réduisant l’accumulation, liée à ces parasites, de larves infectantes dans la pâture. Un sous-dosage pourrait entraîner une utilisation inefficace et favoriser l’apparition d’une résistance.
Illustration : modalités d’injection dans l’oreille :
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Les réactions au point d’injection se produisent plus fréquemment et de façon plus sévère en fonction du volume injecté. Les signes systémiques du surdosage découlent du mode d’action de la moxidectine. Ces signes se présentent sous forme d’une salivation, d’un abattement, d’une somnolence et d’une ataxie transitoires, au cours des 24 à 36 heures suivant le traitement. Aucun traitement particulier n'est généralement nécessaire et la guérison complète s'observe dans les 36 à 72 heures. À des doses supérieures à 3 fois la dose recommandée, réparties sur les deux oreilles, les signes systémiques comprenaient : animal couché, tremblements musculaires, tympanisme du rumen et déshydratation ; ils ont disparu après un traitement par fluides. Les signes systémiques peuvent durer de quelques jours à dix jours. Il n’existe pas d’antidote spécifique.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Viande et abats : 108 jours.
Lait : ne pas administrer à des animaux produisant du lait destiné à la consommation humaine ou à des utilisations industrielles, ou dans un délai de 80 jours avant la date de mise bas prévue.
Ce temps d’attente est valable uniquement pour une seule injection au niveau de l’oreille.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QP54AB02.
4.2 Propriétés pharmacodynamiques
La moxidectine est un antiparasitaire actif contre un large éventail de parasites internes et externes. Il s'agit d'une lactone macrocyclique de seconde génération appartenant à la famille des milbémycines.
La moxidectine agit par interférence avec les récepteurs GABA et les canaux chlore. L'effet résultant est l'ouverture des canaux chlore de la jonction post-synaptique et l'entrée des ions chlore induisant un état de repos irréversible. Ceci provoque une paralysie flasque avec mort éventuelle des parasites exposés au produit vétérinaire.
Les mécanismes exacts de résistance des parasites à la moxidectine sont encore inconnus. Pour l’ivermectine, un mécanisme de résistance impliquant le métabolisme par des glycoprotéines-P et des efflux cellulaires par des transporteurs de type ABC a été proposé, et il est supposé qu’un mécanisme similaire joue un rôle dans la résistance à la moxidectine. Cependant, on sait que des parasites résistant à l’ivermectine présentent un certain niveau de résistance croisée à la moxidectine, mais elle n’est pas complète. L’une des raisons proposées pour cette résistance croisée incomplète est que la moxidectine est dotée de multiples voies d’action chez les parasites cibles, susceptibles d’inclure d’autres récepteurs que les canaux chlore glutamate-dépendants.
4.3 Propriétés pharmacocinétiques
La moxidectine est absorbée après l’injection sous-cutanée avec des concentrations sanguines maximales 24 à 48 heures après l'injection. Le médicament vétérinaire est distribué dans tous les tissus de l’organisme mais en raison de sa liposolubilité, il se concentre principalement dans les tissus gras. La demi-vie par déplétion dans les tissus gras est de 26 à 32 jours.
La moxidectine n'est que peu métabolisée par hydroxylation dans l’organisme. La seule voie d'excrétion significative est représentée par les fèces.
Propriétés environnementales
La moxidectine remplit les critères d'une substance (très) persistante, bioaccumulable et toxique (PBT). Plus particulièrement, lors d’études des toxicités aiguë et chronique portant sur des algues, des crustacés et des poissons, la toxicité de la moxidectine a atteint les chiffres suivants chez ces organismes :
Organisme |
| CE50 | CSEO |
Algues | S. capricornutum | > 86,9 μg/L | 86,9 μg/L |
Crustacés (daphnies) | Daphnia magna (aiguë) | 0,0302 μg/L | 0,011 μg/L |
| Daphnia magna (reproduction) | 0,0031 μg/L | 0,010 μg/L |
Poissons | O. mykiss | 0,160 μg/L | Non déterminée |
| L. macrochirus | 0,620 μg/L | 0,52 μg/L |
| P. promelas (premiers stades de la vie) | Sans objet | 0,0032 μg/L |
| Cyprinus carpio | 0,11 μg/L | Non déterminée |
CE50 : concentration qui entraîne des effets indésirables chez 50 % des animaux d’une espèce testée, à savoir la mortalité et les effets sub-létaux.
CSEO : concentration sans effets observables lors de l’étude.
Cela signifie que lorsque la moxidectine pénètre dans des plans d’eau, cela peut avoir une incidence grave et durable sur la vie aquatique. Afin d’atténuer ce risque, toutes les précautions d’emploi et d’élimination doivent être respectées.
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
Durée de conservation après première ouverture du conditionnement primaire : 28 jours.
5.3 Précautions particulières de conservation
À conserver à une température ne dépassant pas 25°C.
5.4 Nature et composition du conditionnement primaire
Flacon en HDPE contenant 50 mL et 250 mL de solution injectable, hermétiquement fermé à l’aide d’un bouchon en caoutchouc butyle chloré et d’un opercule en aluminium.
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser des dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Le médicament vétérinaire ne doit pas être déversé dans les cours d’eau car la moxidectine pourrait mettre les poissons et autres organismes aquatiques en danger.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
CHANELLE PHARMACEUTICALS MANUFACTURING LIMITED
DUBLIN ROAD, LOUGHREA
- CO. GALWAY
IRLANDE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/6018183 1/2023
Boîte de 1 Flacon de 50 mL
Boîte de 1 Flacon de 250 mL
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
23/06/2023
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
23/06/2023
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments ((https://medicines.health.europa.eu/veterinary).