PESTIGON COMBO 402 MG / 361,8 MG SOLUTION POUR SPOT-ON POUR TRES GRANDS CHIENS
2. Composition qualitative et quantitative
Une pipette 4,02 mL contient : |
|
| |
Substance(s) active(s) : |
|
Fipronil …………………………………………….……..... | 402,0 mg |
(S)-méthoprène …………………………………………... | 361,8 mg |
| |
Excipient(s) : |
|
Butylhydroxytoluène (E321) ……………………….…… | 0,4 mg |
Butylhydroxyanisole (E320) ……………………………... | 0,8 mg |
Pour la liste complète des excipients, voir rubrique « Liste des excipients ».
3. Forme pharmaceutique
Solution pour spot-on.
Solution limpide de couleur jaune.
4. Informations cliniques
4.1. Espèces cibles
Chiens.
4.2. Indications d'utilisation, en spécifiant les espèces cibles
Chez les chiens pesant plus de 40 kg :
A utiliser contre les infestations par les puces seules ou les infestations mixtes par les puces et les tiques et/ou les poux broyeurs.
- Traitement des infestations par les puces (Ctenocephalides spp.). L’efficacité insecticide contre les réinfestations par des puces adultes persiste pendant 8 semaines. Prévention de la multiplication des puces par inhibition du développement des œufs (activité ovicide), des larves et des pupes (activité larvicide) provenant des œufs pondus par les puces adultes jusqu’à 8 semaines après l’application.
- Traitement des infestations par les tiques (Ixodes ricinus, Dermacentor variabilis, Dermacentor reticulatus, Rhipicephalus sanguineus). Le produit présente une efficacité acaricide contre les tiques qui persiste jusqu’à 4 semaines.
- Traitement des infestations par les poux broyeurs (Trichodectes canis).
Le médicament peut être intégré dans un programme de traitement de la Dermatite par Allergie aux Piqûres de Puces (DAPP).
4.3. Contre-indications
En l’absence de données disponibles, ne pas traiter les chiots de moins de 8 semaines.
Ne pas utiliser chez les lapins car des effets indésirables parfois létaux peuvent se produire. En l’absence d’études cliniques, l’utilisation de ce produit n’est pas recommandée chez les espèces non cibles.
Ne pas utiliser chez des animaux malades (ex. maladies systémiques, fièvre) ou convalescents.
Ce produit est spécifiquement développé pour les chiens. Il ne doit dès lors pas être appliqué aux chats et furets au risque de provoquer un surdosage.
Ne pas utiliser en cas d’hypersensibilité aux substances actives ou à l’un des excipients.
4.4. Mises en garde particulières à chaque espèce cible
Les bains/immersions dans l’eau dans les 2 jours suivant l’application du produit et des bains plus fréquents qu’une fois par semaine doivent être évités en l’absence d’étude d’efficacité à ce sujet. Des shampooings émollients peuvent être utilisés avant le traitement, mais ils diminuent la durée de protection contre les puces à environ 5 semaines lorsqu’ils sont utilisés une fois par semaine après l’application du produit. Les bains hebdomadaires avec des shampooings à 2 % de chlorhexidine n’ont en revanche pas diminué l’efficacité du produit contre les puces dans une étude menée sur une durée de 6 semaines.
Il peut y avoir fixation de tiques isolées. Par conséquent, il n’est pas possible d’exclure totalement le développement de maladies infectieuses en cas de conditions défavorables.
Les puces des animaux de compagnie infestent souvent leur panier, leur zone de couchage et leurs zones de repos habituelles comme les tapis et les canapés, qui devraient être traités, en cas d’une infestation massive au début du traitement, avec un insecticide adapté et être aspirés régulièrement.
4.5. Précautions particulières d'emploi
i) Précautions particulières d'emploi chez l'animal
Eviter tout contact avec les yeux de l’animal.
Il est important de veiller à appliquer le produit sur une zone où l’animal ne peut pas se lécher et de s’assurer que les animaux ne se lèchent pas entre eux après le traitement.
ii) Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Ce produit peut provoquer une irritation des muqueuses, de la peau et des yeux. Par conséquent, il convient d’éviter tout contact du produit avec la bouche, la peau et les yeux. Ne pas fumer, boire ou manger pendant l’application du produit. En cas de contact accidentel avec les yeux, rincer immédiatement et abondamment à l’eau claire. Si l’irritation oculaire persiste, consulter un médecin et lui montrer la notice ou l’étiquette du médicament. En cas de contact avec la peau, se laver les mains à l’eau et au savon.
Les personnes présentant une hypersensibilité connue aux insecticides ou à l’alcool doivent éviter tout contact avec ce médicament vétérinaire.
Se laver les mains après utilisation.
L’ingestion du produit est nocive. Veiller à mettre les pipettes hors de portée des enfants et à jeter les pipettes usagées immédiatement après l’application du produit. En cas d’ingestion accidentelle du produit, consulter immédiatement un médecin.
Ne pas manipuler les animaux traités ni laisser des enfants jouer avec les animaux traités tant que le site d’application n’est pas sec. Il est de ce fait conseillé de ne pas traiter les animaux pendant la journée mais plutôt en début de soirée et de ne pas laisser les animaux récemment traités dormir avec leurs propriétaires, en particulier avec des enfants.
iii) Autres précautions
Le fipronil et le (S)-méthoprène peuvent être dangereux pour les organismes aquatiques. Les chiens ne doivent pas être autorisés à nager dans des cours d’eau pendant les 2 jours qui suivent l’application.
L'alcool présent dans le produit peut avoir des effets néfastes sur les surfaces ou les meubles peints, vernis ou les tissus d’ameublement.
4.6. Effets indésirables (fréquence et gravité)
Parmi les très rares effets indésirables suspectés, des cas de réaction cutanée transitoire au niveau du site d’application (décoloration de la peau, alopécie locale, prurit, érythème) et des démangeaisons ou une alopécie généralisées ont été rapportés après l’utilisation. Une hypersalivation, des signes neurologiques réversibles (hyperesthésie, dépression, autres signes nerveux), des vomissements ou des troubles respiratoires ont également été observés après utilisation.
La fréquence des effets indésirables est définie selon la convention suivante :
- très rare (moins d’un animal sur 10 000 animaux traités, cas isolés rapportés compris).
En cas de léchage, une brève période d’hypersalivation principalement due à la nature du solvant peut être observée.
4.7. Utilisation en cas de gestation, de lactation ou de ponte
Le produit peut être utilisé pendant la gestation et la lactation.
4.8. Interactions médicamenteuses et autres formes d'interactions
Aucune connue.
4.9. Posologie et voie d'administration
Posologie :
Une pipette de 4,02 mL par chien pesant plus de 40 kg, ce qui correspond à une dose minimale recommandée de 6,7 mg de fipronil et de 6 mg de (S)-méthoprène par kg de poids corporel.
En l’absence d’études de sécurité, l’intervalle minimal entre les traitements est de 4 semaines.
Voie d’administration :
Usage externe uniquement, utilisation en spot-on.
Extraire la pipette du sachet juste avant usage.
Mode d’administration :
Retirer la pipette du sachet externe à l’aide de ciseaux ou plier le long de la ligne diagonale pour exposer l’encoche prévue, puis déchirer le sachet au niveau de l’encoche.
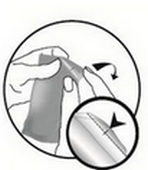
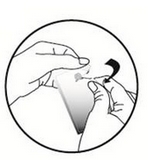
Tenir la pipette en position verticale. Tapoter la partie étroite de la pipette pour s’assurer que tout le contenu se trouve à l’intérieur de la partie principale de la pipette. Tordre l’extrémité de la pipette.
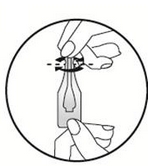
Ecarter les poils sur le dos de l’animal à la base du cou, devant les omoplates, jusqu’à ce que la peau soit visible. Placer l’extrémité de la pipette sur la peau et appuyer plusieurs fois pour en vider entièrement le contenu, directement sur la peau et à un seul endroit.
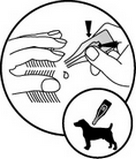
Des changements provisoires (poil gras/amalgamé) peuvent survenir au niveau du pelage entourant le site d’application.
4.10. Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Les études de sécurité menées sur les espèces cibles n’ont mis en évidence aucun effet indésirable chez les chiots de 8 semaines, les jeunes chiens en croissance et les chiens pesant environ 2 kg traités une fois à 5 fois la dose recommandée. Le risque d’effets indésirables (voir rubrique « Effets indésirables ») est susceptible d’augmenter en cas de surdosage. Dès lors, les animaux doivent toujours être traités avec la dose appropriée en fonction de leur poids corporel.
4.11. Temps d'attente
Sans objet.
5. Propriétés pharmacologiques
Groupe pharmacothérapeutique : antiparasitaires externes à usage topique, associant le fipronil.
Code ATC-vet : QP53AX65.
5.1. Propriétés pharmacodynamiques
Le fipronil est un insecticide acaricide appartenant à la famille des phénylpyrazolés. Il agit en interagissant avec des canaux à ions chlorure régulés par des ligands, en particulier ceux régulés par le neurotransmetteur GABA (acide gamma-aminobutyrique), bloquant ainsi le transfert des ions chlorure au travers des membranes cellulaires aux niveaux pré- et post-synaptiques. Il en résulte une activité incontrôlée du système nerveux central et la mort des insectes et des acariens. Le fipronil tue les puces en l’espace de 24 heures, et les tiques (Dermacentor reticulatus, Dermacentor variabilis, Rhipicephalus sanguineus, Ixodes scapularis, Ixodes ricinus, Haemaphysalis longicornis, Haemaphysalis flava, Haemaphysalis campanulata) et poux dans les 48 heures suivant l’exposition.
Le (S)-méthoprène est un régulateur de la croissance des insectes (RCI) de la classe des analogues de l’hormone juvénile, qui inhibent le développement des formes immatures d’insectes. Mimant l’action de l’hormone juvénile, le composé provoque une altération du développement et la mort des formes immatures de puces. L’activité ovicide du (S)-méthoprène appliqué sur l’animal résulte soit de sa pénétration directe dans la coquille des œufs de puce qui viennent d’être pondus, soit de son absorption à travers la cuticule des puces adultes. Le (S)-méthoprène est également efficace dans la prévention du développement des larves et pupes de puce, prévenant ainsi la contamination de l’habitat des animaux traités par les stades immatures de puces.
5.2. Caractéristiques pharmacocinétiques
Les études de métabolisme ont démontré que le fipronil était transformé principalement en son dérivé sulfone.
Le (S)-méthoprène est largement dégradé en dioxyde de carbone et en acétate qui sont ensuite incorporés dans les substances endogènes.
Les profils pharmacocinétiques après application topique du fipronil et du (S)-méthoprène en association ont été étudiés chez le chien et comparés aux profils du fipronil et du (S)-méthoprène administrés séparément par voie intraveineuse. Cette comparaison a permis de définir l’absorption, ainsi que d’autres paramètres pharmacocinétiques. L’application topique a abouti à une faible absorption systémique du fipronil (11 %) avec une concentration plasmatique moyenne maximale (Cmax) d’approximativement 35 ng/mL pour le fipronil et de 55 ng/mL pour le fipronil sulfone. Les pics de concentration plasmatiques de fipronil sont lentement atteints (Tmax moyen d’environ 101 heures) et diminuent également lentement (temps de demi-vie moyen d’environ 154 heures, les valeurs les plus élevées étant enregistrées chez les mâles. Après l’application topique, le fipronil est largement métabolisé en fipronil sulfone.
Les concentrations plasmatiques de (S)-méthoprène étaient inférieures au seuil de quantification (20 ng/mL) chez les chiens après application topique.
Le fipronil et son métabolite principal, ainsi que le (S)-méthoprène se diffusent largement dans le pelage du chien dans le jour qui suit l’application. Les concentrations de fipronil, de fipronil sulfone et de (S)-méthoprène dans le pelage diminuent avec le temps, mais restent détectables au moins 60 jours après l’application. Les parasites sont tués par contact plutôt que par exposition systémique.
Aucune interaction pharmacologique entre le fipronil et le (S)-méthoprène n’a été détectée.
6. Informations pharmaceutiques
6.1. Liste des excipients
Butylhydroxyanisole (E320)
Butylhydroxytoluène (E321)
Ethanol anhydre
Polysorbate 80
Povidone K17
Ether monoéthylique du diéthylène glycol
6.2. Incompatibilités majeures
Aucune connue.
6.3. Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
6.4. Précautions particulières de conservation
A conserver dans l’emballage d’origine afin de protéger le produit de la lumière et de l’humidité.
Pas de précautions particulières de conservation concernant la température.
6.5. Nature et composition du conditionnement primaire
Pipette copolymère de polyéthylène/EVOH/polyéthylène – strate stratifiée laquée sans solvant - polypropylène/COC/polypropylène
6.6. Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
Le fipronil et le (S)-méthoprène peuvent s’avérer toxiques pour les organismes aquatiques. Ne pas contaminer les étangs, les voies d’eau ou les fossés avec le produit ou les conditionnements vides.
7. Titulaire de l'autorisation de mise sur le marché
NORBROOK LABORATORIES (IRELAND)
ROSSMORE INDUSTRIAL ESTATE
- MONAGHAN
IRLANDE
8. Numéro(s) d'autorisation de mise sur le marché
FR/V/2864836 3/2017
Boîte de 1 sachet de 1 pipette de 4,02 mL
Boîte de 2 sachets de 1 pipette de 4,02 mL
Boîte de 3 sachets de 1 pipette de 4,02 mL
Boîte de 4 sachets de 1 pipette de 4,02 mL
Boîte de 6 sachets de 1 pipette de 4,02 mL
Boîte de 8 sachets de 1 pipette de 4,02 mL
Boîte de 12 sachets de 1 pipette de 4,02 mL
Boîte de 24 sachets de 1 pipette de 4,02 mL
Boîte de 30 sachets de 1 pipette de 4,02 mL
Boîte de 60 sachets de 1 pipette de 4,02 mL
Boîte de 90 sachets de 1 pipette de 4,02 mL
Boîte de 120 sachets de 1 pipette de 4,02 mL
Boîte de 150 sachets de 1 pipette de 4,02 mL
Toutes les présentations peuvent ne pas être commercialisées.
9. Date de première autorisation/renouvellement de l'autorisation
25/04/2017 - 22/02/2022
10. Date de mise à jour du texte
07/04/2022