PROTECTIX 40 MG/200 MG SOLUTION SPOT-ON POUR CHIENS JUSQU'A 4 KG
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Une pipette de 0,4 mL contient : |
|
|
|
Substance(s) active(s) : |
|
Imidaclopride ………………………………… | 40,0 mg |
Perméthrine ………………………………….. | 200,0 mg |
Excipient(s) :
Composition qualitative en excipients et autres constituants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Butylhydroxytoluène (E321) | 0,4 mg |
N-méthylpyrrolidone | 187,2 mg |
Triglycérides à chaîne moyenne | / |
Acide citrique (E330) | / |
Solution pour spot-on jaune clair.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles

3.2 Indications d'utilisation pour chaque espèce cible
Traitement et prévention des infestations par les puces (Ctenocephalides canis, Ctenocephalides felis).
Les puces sur les chiens sont tuées dans les 24 heures qui suivent le traitement. Un traitement prévient toute nouvelle infestation de puces pendant quatre semaines. Le médicament vétérinaire peut être utilisé dans le cadre d’une stratégie de traitement de la dermatite allergique aux puces.
Le médicament vétérinaire a une efficacité acaricide et répulsive persistante contre les infestations par les tiques (Rhipicephalus sanguineus et Ixodes ricinus pendant quatre semaines et Dermacentor reticulatus pendant trois semaines).
Par son action répulsive et acaricide sur la tique vectrice Rhipicephalus sanguineus, le médicament vétérinaire réduit la probabilité de transmission du pathogène Ehrlichia canis, réduisant ainsi le risque d’ehrlichiose canine. Les études ont montré que cette protection commence dès le 3ème jour après l’application du produit et persiste pendant 4 semaines.
Les tiques déjà présentes sur le chien au moment du traitement peuvent ne pas être tuées pendant les 2 jours qui suivent l’administration du traitement et peuvent rester attachées et visibles. Par conséquent, il est recommandé de retirer les tiques déjà présentes sur le chien au moment du traitement, afin d’éviter leur attachement et la prise de repas sanguin.
Traitement des infestations par les poux broyeurs (Trichodectes canis).
Un traitement fournit une activité répulsive (anti-gorgement) contre :
- les phlébotomes (Phlebotomus papatasi pendant deux semaines et Phlebotomus perniciosus pendant trois semaines),
- les moustiques (Aedes aegypti pendant deux semaines et Culex pipiens pendant quatre semaines),
- les mouches d’étable (Stomoxys calcitrans) pendant quatre semaines.
Réduction du risque d’infection par Leishmania infantum transmis par les phlébotomes (Phlebotomus perniciosus) pendant une période allant jusqu’à 3 semaines. L’effet est indirect en raison de l’activité du médicament vétérinaire contre le vecteur.
3.3 Contre-indications
En l’absence de données disponibles, le médicament vétérinaire ne doit pas être utilisé chez les chiots âgés de moins de 7 semaines ou pesant moins de 1,5 kg.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
Ne pas utiliser sur les chats. La perméthrine est dangereuse pour les chats.
3.4 Mises en garde particulières
La fixation d’une tique ou la piqûre d’un moustique ou d’un phlébotome reste possible. Par conséquent, la transmission de maladies infectieuses par ces parasites ne peut être totalement exclue si les conditions sont défavorables.
Il est recommandé d’appliquer le traitement au moins 3 jours avant l’exposition prévue à E. canis. En ce qui concerne E. canis, des études ont montré une réduction du risque d’ehrlichiose canine chez les chiens exposés à des tiques Rhipicephalus sanguineus infectées par E. canis à partir de 3 jours suivant l’application du médicament vétérinaire et avec une persistance de 4 semaines.
La protection immédiate contre les piqûres de phlébotomes n’est pas documentée. Les chiens traités pour la réduction du risque d’infection par Leishmania infantum transmis par des phlébotomes P. perniciosus doivent être gardés dans un environnement protégé pendant les 24 premières heures suivant l’application initiale du traitement.
Pour réduire la réinfestation due à l’émergence de nouvelles puces, il est recommandé de traiter tous les chiens du foyer. Les autres animaux vivant dans le même foyer doivent également être traités avec un médicament vétérinaire approprié. Afin d’obtenir une réduction supplémentaire de la pression parasitaire, il est recommandé d’utiliser en complément un traitement approprié de l’environnement contre les puces adultes et leurs stades de développement.
Le médicament vétérinaire reste efficace si l’animal est mouillé. Cependant, une exposition intense et prolongée à l’eau doit être évitée. En cas d’exposition fréquente à l’eau, l’efficacité persistante peut être réduite. Dans ce cas, un intervalle minimum d’une semaine doit être respecté entre deux applications. Si le chien doit être lavé avec un shampooing, il est recommandé de le faire avant l’application du médicament vétérinaire ou au moins 2 semaines après l’application, afin d’optimiser l’efficacité du médicament vétérinaire.
L’utilisation non nécessaire d’antiparasitaires ou l’utilisation non conforme aux instructions données dans le RCP peut augmenter la pression de sélection favorisant la résistance et conduire à une diminution de l’efficacité. La décision d’utiliser le produit doit être fondée sur la confirmation de l’espèce et de la charge parasitaire, ou du risque d’infection sur la base de ses caractéristiques épidémiologiques, pour chaque animal.
La résistance à la perméthrine a été rapportée chez les puces, les tiques (Rhipicephalus sanguineus), les mouches d’étable (Stomoxys calcitrans), les moustiques (Culex pipiens, Aedes aegypti) et les phlébotomes (P. papatasi). L’utilisation de ce produit doit tenir compte des informations locales sur la sensibilité des parasites cibles, lorsqu’elles sont disponibles. Il est recommandé de poursuivre les investigations sur les cas de résistance suspectée, en utilisant une méthode de diagnostic appropriée. La résistance confirmée doit être signalée au titulaire de l’autorisation de mise sur le marché ou aux autorités compétentes.
En l’absence de risque de co-infection par les puces, les tiques et/ou les phlébotomes, un produit à spectre étroit doit être utilisé.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Prendre les précautions nécessaires afin d’éviter tout contact du contenu de la pipette avec les yeux ou la bouche du chien à traiter.
Veiller à administrer le médicament vétérinaire correctement tel que décrit dans la rubrique 3.9. Veiller notamment à empêcher toute ingestion du produit par léchage du site d’application par les animaux traités ou par les animaux en contact avec ces derniers.

Ne pas utiliser sur les chats.
Ce médicament vétérinaire est extrêmement toxique chez les chats et peut être létal, étant donné la physiologie particulière des chats et leur incapacité à métaboliser certains composés dont la perméthrine. Afin d’éviter que les chats ne soient exposés accidentellement au médicament vétérinaire, tenir les chiens traités à l’écart des chats après le traitement jusqu’à ce que le site d’application soit sec. Il est important de s’assurer que les chats ne puissent lécher le site d’application d’un chien récemment traité avec le médicament vétérinaire. Si cela se produit, contacter immédiatement votre vétérinaire.
Consultez votre vétérinaire avant d’utiliser le médicament vétérinaire sur des chiens malades et affaiblis.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Les personnes présentant une sensibilité cutanée connue peuvent être particulièrement sensibles à ce médicament vétérinaire.
Les symptômes cliniques prédominants qui, dans des cas extrêmement rares, peuvent être observés sont des irritations sensorielles transitoires de la peau comme un picotement, une sensation de brûlure ou un engourdissement.
Des études de laboratoire chez le lapin et le rat avec l’excipient N-méthylpyrrolidone ont montré des effets fœtotoxiques. Le médicament vétérinaire ne doit pas être administré par les femmes enceintes et les femmes susceptibles de l’être. Un équipement de protection individuelle composé de gants doit être porté lors de la manipulation du médicament vétérinaire par les femmes en âge de procréer. Les femmes enceintes et les femmes susceptibles de l’être doivent éviter tout contact direct avec l’animal traité pendant les 12 heures suivant l’application du produit.
Les animaux traités ne doivent pas être manipulés pendant au moins 12 heures après l’application du produit. Il est donc recommandé de traiter l’animal le soir. Les animaux traités ne doivent pas être autorisés à dormir avec leurs propriétaires, en particulier les enfants.
Afin d’éviter que les enfants aient accès aux pipettes, conservez la pipette dans son emballage d’origine jusqu’à ce qu’elle soit prête à l’emploi et jetez immédiatement les pipettes usagées.
Éviter tout contact entre le médicament vétérinaire et la peau, les yeux ou la bouche.
Ne pas manger, boire ou fumer pendant l’application.
Se laver soigneusement les mains après usage.
En cas de contact accidentel avec la peau, laver immédiatement avec de l’eau et du savon.
En cas de contact accidentel du médicament vétérinaire avec les yeux, rincez-les soigneusement à l’eau. Si l’irritation de la peau ou des yeux persiste, consulter immédiatement un médecin et lui montrer la notice ou l’étiquette.
Ne pas ingérer. En cas d’ingestion accidentelle, demander immédiatement conseil à un médecin et lui montrer la notice ou l’étiquetage.
Ce médicament contient du butylhydroxytoluène et peut provoquer des réactions cutanées locales (par exemple dermatite de contact) ou une irritation des yeux et des muqueuses.
Précautions particulières concernant la protection de l'environnement
Pour prévenir les effets néfastes sur les organismes aquatiques, les chiens traités ne doivent pas accéder aux cours d’eau pendant 48 heures après le traitement.
Autres précautions
Le solvant contenu dans le médicament vétérinaire peut tacher certains matériaux, notamment le cuir, les tissus, les plastiques et les surfaces texturées. Laisser sécher le site d’application avant de permettre le contact avec de tels matériaux.
3.6 Effets indésirables
Chiens :
Peu fréquent (1 à 10 animaux / 1 000 animaux traités) : | Démangeaisons au site d’application, modification des poils au site d’application (par exemple fourrure grasse au site d’application) Vomissements |
Rare (1 à 10 animaux / 10 000 animaux traités) : | Érythème au site d’application, inflammation au site d’application, perte de poil au site d’application Diarrhées |
Très rare ( < 1 animal / 10 000 animaux traités, incluant les rapports isolés) : | Sensibilité accrue de la peau (grattement, frottement)1 Léthargie1 Troubles du comportement (excitation, agitation, gémissement ou roulement sur le sol)1, 2, 3 Troubles de l’appareil digestif (hypersalivation, diminution de l’appétit)1, 2, 3 Signes neurologiques (par exemple mouvements anormaux, secousses musculaires)1, 2, 3 |
1 généralement auto-résolutifs, 2 transitoires, 3 chez les chiens sensibles à la perméthrine
Une intoxication consécutive à une absorption orale accidentelle chez le chien est peu probable, mais peut survenir dans de très rares cas. Dans ce cas, des signes neurologiques tels que tremblements et léthargie peuvent survenir. Le traitement doit être symptomatique. Il n’existe pas d’antidote connu.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la rubrique « coordonnées » de la notice.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation :
L’innocuité du médicament vétérinaire n’a pas été établie en cas de gestation, lactation, ou chez les animaux destinés à la reproduction. Des études de laboratoire chez le lapin et le rat avec l’excipient N-méthylpyrrolidone ont montré des effets fœtotoxiques. L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
3.8 Interactions médicamenteuses et autres formes d'interactions
Aucune connue.
3.9 Voies d'administration et posologie
Solution spot-on pour usage externe uniquement. Appliquer uniquement sur la peau intacte. Les animaux doivent être pesés avec précision avant le traitement.
La dose minimale de traitement est de 10 mg/kg de poids corporel (PC) d’imidaclopride et de 50 mg/kg de PC de perméthrine, ce qui équivaut à 1 pipette de 0,4 mL pour un petit chien ( ≥ 1,5 kg à 4 kg) correspondant à une dose de 10-27 mg/kg PC d’imidaclopride et de 50-133 mg/kg de PC de perméthrine.
Pour les chiens de plus de 1,5 kg jusqu’à 4 kg :
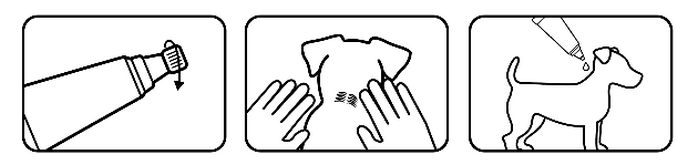
Sortir une pipette de l’emballage. Tenir la pipette en position verticale et dévisser le bouchon. Écarter le pelage entre les omoplates jusqu’à ce que la peau soit visible.
Placer l’extrémité de la pipette sur la peau et presser fermement plusieurs fois pour vider le contenu directement sur la peau.
En cas d’infestation de poux broyeurs, un examen vétérinaire supplémentaire 30 jours après le traitement est recommandé, car certains animaux peuvent nécessiter un second traitement.
Pour protéger un chien pendant toute la saison des phlébotomes, le traitement doit être poursuivi de manière conforme pendant toute la période.
Un sous-dosage peut entraîner une utilisation inefficace et favoriser le développement de résistances.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
L’application de doses équivalentes à 5 fois la dose thérapeutique chez des chiens adultes ou des chiots sains n’a produit aucun signe clinique indésirable. Il en est de même chez les chiots dont la mère a reçu 3 fois la dose thérapeutique de l’association imidaclopride/perméthrine. La sévérité de l’éruption cutanée qui peut parfois apparaître au site d’application augmente avec le surdosage.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QP53AC54.
4.2 Propriétés pharmacodynamiques
Le médicament vétérinaire est un ectoparasiticide à usage topique contenant de l’imidaclopride et de la perméthrine. Cette combinaison agit comme insecticide, acaricide et répulsif.
L’imidaclopride est un ectoparasiticide appartenant à la famille des chloronicotinile. Du point de vue chimique, il s’agit d’une chloronicotinyl nitroguanidine. L’imidaclopride est efficace contre les puces adultes et les puces au stade larvaire. Outre l’efficacité contre les puces adultes, un effet larvicide de l’imidaclopride dans l’environnement de l’animal de compagnie traité a également été démontré. Les stades larvaires présents dans l’environnement direct du chien traité sont tués par contact avec un animal traité. La substance possède une forte affinité pour les récepteurs nicotiniques post-synaptiques de l’acétylcholine au niveau du système nerveux central (SNC) des insectes. L’inhibition de la transmission cholinergique qui s’ensuit chez les insectes conduit à la paralysie et à la mort des parasites.
La perméthrine est un pyréthrinoïde de type I, acaricide et insecticide, qui agit aussi comme répulsif. Les pyréthrinoïdes affectent les canaux sodiques voltage-dépendant chez les vertébrés et les invertébrés. Les pyréthroïdes sont des « bloqueurs de canaux ouverts » ; ils affectent les canaux sodiques en ralentissant à la fois les propriétés d’activation et d’inactivation conduisant ainsi à l’hyperexcitabilité et à la mort du parasite.
Il a été démontré que l’imidaclopride, au sein de l’association des deux substances, stimule l’activité nerveuse ganglionnaire des arthropodes et augmente ainsi l’efficacité de la perméthrine.
Le médicament vétérinaire possède une activité répulsive (anti-gorgement) contre Phlebotomus perniciosus ( > 80 % pendant 3 semaines), les moustiques et les tiques. Des données sur le terrain provenant d’une zone d’endémie ont montré que le médicament vétérinaire réduit indirectement le risque de transmission de Leishmania infantum par des phlébotomes infectés (Phlebotomus perniciosus) pendant une période allant jusqu’à 3 semaines, réduisant ainsi le risque de leishmaniose canine chez les chiens traités.
Une résistance à la perméthrine peut se développer et il est connu que la résistance se manifeste par des mutations uniques ou multiples de son site cible principal, les canaux sodiques voltage-dépendants (VGSC), communément appelé résistance au knockdown (mutation kdr ou skdr). D’autres mécanismes de développement de la résistance comprennent l’épaississement de la cuticule et la résistance métabolique via la surexpression des mono-oxygénases P450 métabolisantes, des estérases et des glutathion-S-transférases.
4.3 Propriétés pharmacocinétiques
Le médicament vétérinaire est destiné à une administration par voie cutanée. Après une application topique chez le chien, la solution est rapidement distribuée sur le corps de l’animal. Les deux principes actifs restent détectables sur la peau et le poil des animaux traités pendant 4 semaines.
Les études de tolérance locale aiguë chez le rat et l’espèce cible ainsi que les études de surdosage et de cinétique sanguine ont démontré que l’absorption systémique des deux substances après application sur une peau saine est très faible, transitoire et n’intervient pas dans l’efficacité clinique.
Propriétés environnementales
Le médicament vétérinaire ne doit pas être déversé dans les cours d’eau, car cela pourrait être nocif pour les poissons et les organismes aquatiques. Pour les chiens traités, veuillez consulter la section 3.5.
Les produits contenant de l’imidaclopride et de la perméthrine sont toxiques pour les abeilles mellifères.
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
En l’absence d’étude de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 18 mois.
Durée de conservation après première ouverture du conditionnement primaire : utiliser immédiatement.
5.3 Précautions particulières de conservation
Ne pas mettre au réfrigérateur, ne pas congeler.
Conserver les pipettes dans l’emballage d’origine afin de protéger contre la lumière et l’humidité.
5.4 Nature et composition du conditionnement primaire
Type de contenant : | Pipette blanche en polypropylène. |
Matériau de l’emballage secondaire : | Sachet en PET/PE/aluminium/surlyn (sécurité enfant) contenant une pipette. |
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Le médicament vétérinaire ne doit pas être déversé dans les cours d’eau, car la perméthrine et l’imidaclopride pourraient mettre les poissons et autres organismes aquatiques en danger.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
BEAPHAR B.V.
DROSTENKAMP 3
8101BX RAALTE
PAYS-BAS
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/9552463 0/2023
Boîte de 1 pipette de dose unitaire
Boîte de 2 pipettes de dose unitaire
Boîte de 3 pipettes de dose unitaire
Boîte de 4 pipettes de dose unitaire
Boîte de 6 pipettes de dose unitaire
Boîte de 12 pipettes de dose unitaire
Boîte de 24 pipettes de dose unitaire
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
15/12/2023
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
20/04/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire non soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).