TRAMCOAT 17,6 MG COMPRIMES PELLICULES POUR CHIENS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé contient : |
|
|
|
Substance(s) active(s) : |
|
|
|
Tramadol……………………………………………….. | 17,60 mg |
(sous forme de chlorhydrate) |
|
(équivalant à 20 mg de chlorhydrate de tramadol) |
|
|
|
Excipient(s) : |
|
Composition qualitative en excipients et autres composants : |
Noyau du comprimé |
Cellulose microcristalline |
Saccharine sodique |
Vanilline |
Lactose monohydraté |
Carboxyméthylamidon sodique type A |
Stéarate de magnésium |
Silice colloïdale hydratée |
Pelliculage du comprimé |
Dioxyde de titane |
Poly(alcool vinylique) |
Talc |
Monocaprylocaprate de glycérol |
Laurilsulfate de sodium |
Pigment Jaune : Oxyde de fer jaune, oxyde de fer rouge |
Comprimé pelliculé jaune ayant une forme de boule modifiée (dimension 6 mm).
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chiens.
3.2 Indications d'utilisation pour chaque espèce cible
Réduction des douleurs aiguës et chroniques peu intenses des tissus mous et de l’appareil musculo-squelettique.
3.3 Contre-indications
Ne pas administrer conjointement avec des antidépresseurs tricycliques, des inhibiteurs de la monoamine oxydase et des inhibiteurs de la recapture de la sérotonine.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
Ne pas utiliser chez les animaux souffrant d’épilepsie.
3.4 Mises en garde particulières
Les effets analgésiques du chlorhydrate de tramadol peuvent varier. Cette variabilité serait due à des différences individuelles dans le métabolisme du médicament qui aboutit au principal métabolite actif, le O-déméthyltramadol. Chez certains chiens (ne répondant pas au traitement), le médicament vétérinaire peut ainsi ne pas induire d’analgésie. En cas de douleur chronique, une analgésie multimodale doit être envisagée. Les chiens doivent être régulièrement surveillés par un vétérinaire afin d’assurer un soulagement adéquat de la douleur. En cas de douleur récidivante ou d’analgésie insuffisante, le protocole analgésique peut être revu.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Les comprimés sont aromatisés. Afin d’éviter toute ingestion accidentelle, ranger les comprimés hors de portée des animaux. Utiliser avec précaution chez les chiens présentant une insuffisance rénale ou hépatique. Le métabolisme du tramadol conduisant à la formation de métabolites actifs peut être réduit chez les chiens présentant une insuffisance hépatique, ce qui peut diminuer l’efficacité du médicament vétérinaire. L’un des métabolites actifs du tramadol étant excrété par les reins, la posologie pourrait avoir besoin d’être ajustée chez les chiens présentant une insuffisance rénale. Les fonctions rénale et hépatique doivent être surveillées lors de l’utilisation du médicament vétérinaire. L’arrêt d’un traitement analgésique de longue durée doit se faire progressivement quand cela est possible.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Le tramadol peut provoquer une sédation, des nausées et des étourdissements après une ingestion accidentelle. Afin d’éviter toute ingestion accidentelle, en particulier chez l’enfant, les plaquettes devraient être replacées dans la boîte et conserver cette dernière dans un lieu sûr hors de la vue et de la portée des enfants. En cas d’ingestion accidentelle, en particulier chez l’enfant, demandez conseil à un médecin et montrez-lui la notice ou l’étiquette. En cas d’ingestion accidentelle chez l’adulte : NE PAS CONDUIRE, car des effets sédatifs sont possibles.
Se laver les mains après utilisation.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Chiens :
Fréquent (1 à 10 animaux/100 animaux traités) : | Sédation1,2 ; somnolence - trouble neurologique2 |
Peu fréquent (1 à 10 animaux/1000 animaux traités) : | Nausées ; vomissement |
Rare (1 à 10 animaux/10 000 animaux traités) : | Hypersensibilité3 |
Très rare (< 1 animal/10 000 animaux traités, y compris les cas isolés) : | Convulsion4 |
1 Léger.
2 Surtout lorsque des doses plus fortes sont administrées.
3 En cas d’hypersensibilité, le traitement doit être interrompu.
4 Chez les chiens ayant un seuil convulsif bas.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la rubrique « Coordonnées » de la notice.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation :
Les études de laboratoire menées sur la souris et/ou le rat et le lapin n’ont pas mis en évidence d’effets tératogènes, fœtotoxiques et maternotoxiques et d’effets indésirables sur le développement péri- et postnatal de la progéniture. L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
Fertilité :
Lors des études de laboratoire sur la souris et/ou le rat et le lapin, l’utilisation de tramadol à des doses thérapeutiques n’a pas eu d’effets indésirables ni sur les paramètres de la reproduction ni sur la fertilité des mâles et des femelles. L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
3.8 Interactions médicamenteuses et autres formes d'interactions
L’administration concomitante du médicament vétérinaire avec des dépresseurs du système nerveux central peut potentialiser les effets dépresseurs sur l’appareil respiratoire et sur le système nerveux central. Le tramadol peut amplifier l’effet des médicaments qui abaissent le seuil épileptogène.
Les médicaments ayant un effet inhibiteur (p. ex. la cimétidine ou l’érythromycine) ou inducteur (p. ex. la carbamazépine) sur le métabolisme lié au cytochrome P450 peuvent influer sur l’effet analgésique du tramadol. L’importance clinique de ces interactions n’a pas été étudiée chez le chien.
L’association du tramadol avec des mélanges d’agonistes / antagonistes (p. ex. buprénorphine, butorphanol) n’est pas conseillée, car l’effet analgésique d’un agoniste pur peut théoriquement être réduit dans de telles circonstances.
Voir aussi la rubrique 3.3 Contre-indications.
3.9 Voies d'administration et posologie
Voie orale.
La dose recommandée est de 2 à 4 mg de chlorhydrate de tramadol par kg de poids corporel toutes les 8 heures ou selon les besoins, en fonction de l’intensité de la douleur.
Les doses doivent être espacées de 6 heures au minimum. La dose quotidienne maximale recommandée est de 16 mg/kg. La réponse au tramadol étant variable selon l’individu et dépendant en partie de la posologie, de l’âge de l’animal, des différences individuelles de sensibilité à la douleur et de l’état général de l’animal, la posologie optimale doit être adaptée au cas par cas en s’appuyant sur les plages de doses et les fréquences de renouvellement mentionnées ci-dessus. Le chien doit être examiné régulièrement par un vétérinaire pour déterminer si une analgésie supplémentaire est requise. L’analgésie supplémentaire peut être obtenue en augmentant la dose de tramadol jusqu’à l’atteinte de la dose quotidienne maximale atteinte, et/ou en suivant une approche d’analgésie multimodale par ajout d’autres analgésiques adaptés.
Veuillez noter que ce tableau posologique est destiné à servir de guide pour administrer le médicament vétérinaire à la limite supérieure de la plage de dose maximale : 4 mg/kg de poids corporel. Il indique le nombre et le type de comprimés requis à administrer pour une dose de 4 mg de chlorhydrate de tramadol par kg de poids corporel.
La dose recommandée est de 2 à 4 mg de chlorhydrate de tramadol par kg. Dans ce tableau, un exemple de 4 mg de chlorhydrate de tramadol par kg est indiqué.
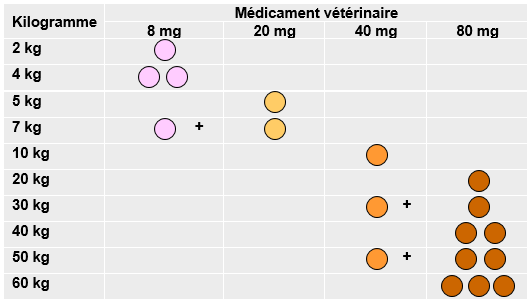
Une combinaison adéquate de tailles de comprimés doit être utilisée afin d’administrer la dose optimale pour chaque chien. Afin de garantir une posologie appropriée, le poids corporel doit être déterminé aussi précisément que possible.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
En cas d’intoxication au tramadol, des symptômes similaires à ceux observés avec d’autres analgésiques à action centrale (opiacés) sont susceptibles de se produire. Ils comprennent en particulier, un myosis, des vomissements, un collapsus cardio-vasculaire, des troubles de la conscience pouvant aller jusqu’au coma, des convulsions et une dépression respiratoire pouvant aller jusqu’à l’asphyxie.
Mesures d’urgence générales : maintenir les voies respiratoires dégagées, assurer un soutien cardio-respiratoire selon les symptômes. Induire le vomissement afin de vider l’estomac est approprié sauf si l’animal affecté montre un état de conscience réduit, dans ce cas un lavage gastrique peut être envisagé.
L’antidote en cas de dépression respiratoire est la naloxone. Toutefois, la naloxone peut ne pas être efficace dans tous les cas de surdosage au tramadol, car elle pourrait n’inverser que partiellement certains des autres effets du tramadol. En cas de crises convulsives, administrer du diazépam.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QN02AX02
4.2 Propriétés pharmacodynamiques
Le tramadol est un analgésique à action centrale dont le mécanisme d’action est complexe, celui-ci étant exercé par ses 2 énantiomères et son métabolite primaire, en faisant intervenir les récepteurs aux opioïdes, à la noradrénaline et à la sérotonine. L’énantiomère (+) du tramadol présente une faible affinité pour les récepteurs μ aux opioïdes, inhibe la capture de la sérotonine et amplifie sa libération. L’énantiomère (-) inhibe préférentiellement la recapture de la noradrénaline. Le métabolite O-déméthyltramadol dispose d’une plus forte affinité pour les récepteurs µ aux opioïdes.
Contrairement à la morphine, le tramadol est dépourvu d’effet dépresseur sur la respiration dans un large intervalle de doses analgésiques. De même, il n’a pas d’influence sur la motilité gastro-intestinale. Les effets sur le système cardio-vasculaire ont tendance à être de faible intensité. La puissance analgésique du tramadol est d’environ 1/10ème à 1/6ème de celle de la morphine.
4.3 Propriétés pharmacocinétiques
Le tramadol est facilement absorbé. Après une administration orale unique de 4,4 mg de chlorhydrate de tramadol par kg de poids corporel, les concentrations plasmatiques maximales de 152 ng de tramadol par mL sont atteintes en 1 heure. La nourriture n’a pas d’effet significatif sur l’absorption du médicament.
Le tramadol est métabolisé dans le foie par déméthylation via le cytochrome P450, puis par conjugaison avec l’acide glucuronique. Chez le chien, les taux de métabolite actif O-déméthyltramadol sont plus faibles que chez l’être humain. L’élimination se fait principalement par les reins, la demi-vie d’élimination étant d’environ 50 minutes.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
Sans objet.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 27 mois
5.3 Précautions particulières de conservation
À conserver à une température ne dépassant pas 30 °C.
5.4 Nature et composition du conditionnement primaire
Plaquettes en aluminium-PVC/PE/PVDC contenant chacune 10 comprimés.
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
ALFASAN NEDERLAND B.V.
KUIPERSWEG 9
3449 JA WOERDEN
PAYS-BAS
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/0442633 0/2024
Boîte en carton contenant 1 plaquette de 10 comprimés
Boîte en carton contenant 2 plaquettes de 10 comprimés
Boîte en carton contenant 3 plaquettes de 10 comprimés
Boîte en carton contenant 4 plaquettes de 10 comprimés
Boîte en carton contenant 5 plaquettes de 10 comprimés
Boîte en carton contenant 6 plaquettes de 10 comprimés
Boîte en carton contenant 7 plaquettes de 10 comprimés
Boîte en carton contenant 8 plaquettes de 10 comprimés
Boîte en carton contenant 9 plaquettes de 10 comprimés
Boîte en carton contenant 10 plaquettes de 10 comprimés
Boîte en carton contenant 12 plaquettes de 10 comprimés
Boîte en carton contenant 25 plaquettes de 10 comprimés
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
05/04/2024
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
05/04/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments(https://medicines.health.europa.eu/veterinary).