VERSICAN PLUS BB ORAL LYOPHILISAT ET SOLVANT POUR SUSPENSION BUVABLE POUR CHIENS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Une dose de 1 mL contient : |
|
| |||||||||||||
|
|
| |||||||||||||
Substance(s) active(s) : |
|
| |||||||||||||
Lyophilisat : |
| ||||||||||||||
|
|
| |||||||||||||
Bordetella bronchiseptica vivant atténué souche 92 B : | 1,4 x 108 à 5,5 x 109 UFC (*) | ||||||||||||||
(*) UFC : unité formant colonie. |
|
| |||||||||||||
|
|
| |||||||||||||
Excipient(s) : |
|
| |||||||||||||
|
|
| |||||||||||||
L’apparence visuelle est la suivante :
Lyophilisat : poudre lyophilisée de couleur crème uniforme.
Solvant : Liquide incolore clair
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chiens.
3.2 Indications d'utilisation pour chaque espèce cible
Immunisation active chez les chiens âgés de 8 semaines ou plus afin de réduire les signes cliniques suivant une infection à Bordetella bronchiseptica.
Mise en place de l'immunité : 7 jours.
Durée de l'immunité : 1 an.
3.3 Contre-indications
Aucune.
3.4 Mises en garde particulières
Vacciner uniquement les animaux en bonne santé.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Ce médicament vétérinaire contient des bactéries vivantes et doit être administré uniquement par voie orale. Une administration parentérale peut générer des abcès et de la cellulite.
Les chiens vaccinés peuvent excréter la souche vaccinale de Bordetella bronchiseptica jusqu'à 35 jours par voie oro-nasale et jusqu'à 70 jours dans les fèces suivant la vaccination.
En raison de la nature atténuée de la souche vaccinale, il n'est pas nécessaire de séparer les chiens non vaccinés des chiens vaccinés. Cependant, durant cette période, il est conseillé aux chiens immunodéprimés d'éviter tout contact avec des chiens vaccinés.
Il a été démontré que le Bordetella bronchiseptica du médicament vétérinaire était sans danger chez les porcs exposés à la souche vaccinale (par exemple, par contact avec des chiens vaccinés). Les chats exposés à la souche vaccinale (par exemple, par contact avec des chiens vaccinés) peuvent présenter des signes cliniques modérés, tels qu'éternuements, écoulement nasal et larmoiement.
L’innocuité des bactéries contenues dans le médicament vétérinaire et transmises par les chiens vaccinés n’a pas été étudiée chez d’autres espèces animales.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Désinfecter les mains et l'équipement après utilisation.
En cas d'auto-injection accidentelle durant la reconstitution du médicament vétérinaire, demander immédiatement conseil à un médecin et lui montrer la notice ou l'étiquette.
Les personnes administrant le médicament vétérinaire aux chiens doivent être informées que l'exposition répétée à ce médicament vétérinaire peut conduire dans de rares cas à des réactions d'hypersensibilité.
Il est conseillé aux personnes immunodéprimées d’éviter tout contact avec le médicament vétérinaire et les chiens vaccinés pendant la période d'excrétion oronasale.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Chiens :
Rare (1 à 10 animaux / 10 000 animaux traités): | Ecoulement oculaire1 |
Très rare ( < 1 animal / 10 000 animaux traités, y compris les cas isolés): | Diarrhée2, Vomissement2 Réaction d’hypersensibilité (par exemple anaphylaxie, dyspnée, et/ou tachypnée, œdème facial, urticaire)3 Écoulement nasal2, Toux2 Léthargie2 |
1Léger.
2Léger jusqu’à 14 jours après la vaccination.
3Si une réaction d’hypersensibilité se produit, un traitement approprié doit être administré sans délai.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la rubrique « Coordonnées » de la notice.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation :
L’innocuité de ce produit vétérinaire n’a pas été établie en cas de gestation ou lactation. Par conséquent, l'utilisation n'est pas recommandée chez les chiennes gestantes ou allaitantes.
3.8 Interactions médicamenteuses et autres formes d'interactions
Ne pas utiliser d'agents immunosuppresseurs dans le mois qui suit la vaccination avec le médicament vétérinaire.
Ne pas administrer d’antibiotiques pendant les 14 jours suivant la vaccination.
L’innocuité de ce médicament vétérinaire a été démontrée lors d'administration simultanée des gammes Versican Plus et Vanguard contenant des virus vivants (parvovirus canins, adénovirus, virus de la maladie de Carré, virus parainfluenza) ainsi que des agents inactivés (leptospires, virus de la rage). L'efficacité après utilisation simultanée n'a pas été testée.
Aucune information n'est disponible sur l'innocuité et l'efficacité de ce médicament vétérinaire lorsqu'il est utilisé avec un autre médicament vétérinaire. La décision d'utiliser ce médicament vétérinaire avant ou après tout autre médicament vétérinaire doit donc être prise au cas par cas.
3.9 Voies d'administration et posologie
Voie orale.
Méthode et voie d’administration :
Saisissez le flacon de lyophilisat avec vos doigts et placez votre pouce directement sous le triangle en relief sur le capuchon du flacon.
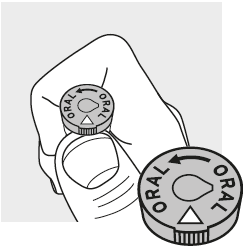
À l'aide de votre pouce, poussez le capuchon du flacon vers le haut à partir du dessous du triangle en relief pour permettre l'accès au bouchon en caoutchouc.
Ne retirez pas le capuchon du flacon ou le collier en aluminium car ils ne sont pas conçus pour être retirés pour une utilisation avec une seringue et une aiguille.
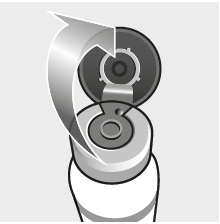
Reconstituer aseptiquement le lyophilisat avec le solvant. Le médicament vétérinaire reconstitué doit être un liquide trouble de couleur orange à jaune pouvant contenir un sédiment meuble se remettant en suspension.
Bien agiter le médicament vétérinaire après reconstitution. Prélevez le liquide avec la seringue et retirez l'aiguille. Le médicament vétérinaire doit alors être utilisé immédiatement.
La tête du chien doit être tenue avec le nez pointé vers le haut et la bouche ouverte. Administrer la totalité de la dose de 1 mL dans la poche buccale (entre les dents et la muqueuse buccale).
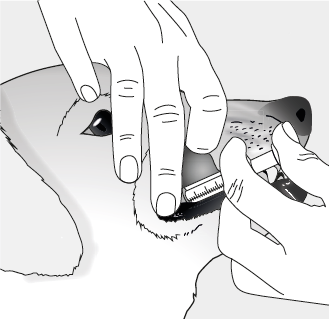
Schéma de primo-vaccination :
Vaccination avec 1 dose de 1 mL par chien à partir de l'âge de 8 semaines.
Schéma de rappel :
Une dose annuellement.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Aucun effet indésirable autres que ceux mentionnés à la rubrique 3.6 n’a été observé après une surdose du médicament vétérinaire de dix fois la dose.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS IMMUNOLOGIQUES
4.1 Code ATCvet
QI07AE01
Vaccin vivant permettant une immunisation active contre Bordetella bronchiseptica chez les chiens.
Une réduction significative de l'excrétion bactérienne suite à une infection à Bordetella bronchiseptica a été démontrée chez les chiens vaccinés à partir de 3 semaines après la vaccination, avec une durée d'immunité d’1 an.
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
Ne pas mélanger avec d'autres médicaments vétérinaires à l'exception du solvant fourni pour être utilisé avec ce médicament vétérinaire.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
Durée de conservation après reconstitution conforme aux instructions : à utiliser immédiatement.
5.3 Précautions particulières de conservation
A conserver et transporter réfrigéré (entre 2°C et 8°C).
Ne pas congeler.
Protéger de la lumière.
5.4 Nature et composition du conditionnement primaire
Lyophilisat :
Flacon : flacon verre type I.
Fermeture : bouchon caoutchouc chlorobutyle sellé avec une capsule aluminium et opercule plastique colorée.
Solvant :
Flacon : flacon verre type I
Fermeture : bouchon chlorobutyle scellé avec une capsule aluminium et opercule plastique colorée.
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
ZOETIS FRANCE
10 RUE RAYMOND DAVID
92240 MALAKOFF
FRANCE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/6855258 5/2018
Boîte de 5 flacons de 1 dose de lyophilisat et de 5 flacons de 1 mL de solvant
Boîte de 10 flacons de 1 dose de lyophilisat et de 10 flacons de 1 mL de solvant
Boîte de 25 flacons de 1 dose de lyophilisat et de 25 flacons de 1 mL de solvant
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
20/12/2018 - 28/01/2022
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
11/12/2023
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).