BIMEPRO 5 MG/ML SOLUTION POUR POUR-ON POUR BOVINS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un mL de solution contient :
Substance active :
Éprinomectine 5,00 mg
Excipients :
Composition qualitative en excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Butylhydroxytoluène (E 321) | 0,10 mg |
Tout-rac-alpha-tocophérol (E 307) | 0,06 mg |
Dicaprylocaprate de propylèneglycol |
|
Solution limpide jaune pâle à jaune.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Bovins (bovins à viande et vaches laitières).
3.2 Indications d'utilisation pour chaque espèce cible
Traitement des infestations par les parasites suivants :
PARASITE | ADULTES | Stade L4 | Larves L4 inhibées |
Nématodes gastro-intestinaux | |||
Ostertagia ostertagi Ostertagia lyrata Haemonchus placei Trichostrongylus axei Trichostrongylus colubriformis Cooperia spp. Cooperia oncophora Cooperia punctata Cooperia pectinata Cooperia surnabada Bunostomum phlebotomum Nematodirus helvetianus Oesophagostomum radiatum Oesophagostomum sp. Trichuris discolor | ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ | ♦
♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦
| ♦
♦
|
Strongles pulmonaires | |||
Dictyocaulus viviparus | ♦ | ♦ |
|
- Hypodermes (stades parasitaires) :
Hypoderma bovis
Hypoderma lineatum
- Acariens responsables de la gale :
Chorioptes bovis
Sarcoptes scabiei var. bovis
- Poux piqueurs :
Linognathus vituli
Haematopinus eurysternus
Solenopotes capillatus
- Poux broyeurs :
Bovicola (Damalinia) bovis
- Mouches des cornes :
Haematobia irritans
Le produit protège les animaux contre les réinfestations par :
- Nematodirus helvetianus pendant 14 jours.
- Trichostrongylus axei pendant 21 jours.
- Dictyocaulus viviparus, Haemonchus placei, Cooperia oncophora, Cooperia punctata, Cooperia surnabada, Oesophagostomum radiatum et Ostertagia ostertagi pendant 28 jours.
Des variations dans la durée de la persistance de l’efficacité contre Cooperia spp et H. placei peuvent être observées 14 jours après le traitement, en particulier chez les animaux jeunes et maigres au moment du traitement.
3.3 Contre-indications
Les avermectines peuvent ne pas être bien tolérées par les espèces non-cibles (notamment les chiens, les chats et les chevaux. Des cas de mortalité ont été rapportés chez les chiens, notamment chez les colleys, les bobtails et les races apparentées ou croisées, ainsi que chez les tortues.
Ne pas utiliser chez d’autres espèces animales.
Ne pas administrer par voie orale ou par injection.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
3.4 Mises en garde particulières
Une utilisation d’antiparasitaires non nécessaire ou s’écartant des prescriptions du RCP peut augmenter la pression de sélection de la résistance et entraîner une réduction de l’efficacité. La décision d’utiliser le médicament vétérinaire doit être fondée sur la confirmation de l’espèce et de la charge parasitaires ou du risque d’infestation d’après ses caractéristiques épidémiologiques, pour chaque animal ou troupeau.
Pour une utilisation efficace, le médicament vétérinaire ne doit pas être appliqué sur les zones de la ligne dorsolombaire recouvertes de boue ou de fumier.
Le médicament vétérinaire doit uniquement être appliqué sur une peau saine.
L’utilisation répétée pendant une période prolongée, en particulier lorsqu’il s’agit de la même classe de substances, augmente le risque de développement d’une résistance. Au sein d’un troupeau, le maintien de refuges sensibles est essentiel pour réduire ce risque. Il convient d’éviter d’administrer le traitement de façon systématique par intervalles de même que le traitement de l’ensemble d’un troupeau. Au lieu de cela, si possible, seuls certains animaux ou sous-groupes doivent être traités (traitement sélectif ciblé). Ces mesures doivent être combinées à des mesures appropriées d’élevage et de gestion des pâturages. Des conseils adaptés à chaque troupeau peuvent être obtenus auprès du vétérinaire responsable.
Les suspicions de cas de résistance doivent faire l’objet d’analyses complémentaires au moyen de tests diagnostiques appropriés (par exemple, test de réduction de l’excrétion fécale des œufs). En cas de forte suspicion de résistance à un anthelminthique donné, suite à des tests, un anthelminthique appartenant à une autre classe pharmacologique et présentant un autre mécanisme d’action devra être utilisé.
Afin de limiter les transferts croisés d’éprinomectine, les animaux traités doivent de préférence être séparés des animaux non traités. Le non-respect de cette recommandation peut entraîner la présence de résidus chez les animaux non traités et le développement d’une résistance à l’éprinomectine.
Jusqu’à présent, aucun cas de résistance à l’éprinomectine (lactone macrocyclique) n’a été rapporté chez les bovins au sein de l’UE. Cependant, des cas de résistance à d’autres lactones macrocycliques ont été rapportés chez certaines espèces de parasites des bovins au sein de l’UE. Par conséquent, l’utilisation de ce produit doit être fondée sur des informations épidémiologiques locales (régionales, au niveau de l’exploitation) concernant la sensibilité de ces nématodes et sur des recommandations concernant la manière de limiter la sélection ultérieure de la résistance aux anthelminthiques.
S’il existe un risque de réinfestation, demander l’avis d’un vétérinaire concernant le besoin et la fréquence d’administrations répétées.
Pour des résultats optimaux, le produit doit s’inscrire dans un programme visant à contrôler les parasites tant internes qu’externes chez les bovins, reposant sur les informations épidémiologiques de ces parasites.
Si la résistance est confirmée, elle doit être signalée au titulaire de l’autorisation de mise sur le marché ou aux autorités compétentes.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Usage externe uniquement.
Pour éviter les effets indésirables dus à la mort des larves d’hypodermes dans l’œsophage ou la colonne vertébrale, il est recommandé d’administrer le produit à la fin de la période d’activité des mouches et avant que les larves n’atteignent ces sites ; consulter un vétérinaire pour connaître la période appropriée de traitement.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Ce produit peut être irritant pour la peau et les yeux et peut provoquer une hypersensibilité (réactions allergiques).
Éviter tout contact avec la peau et les yeux pendant le traitement et lors de la manipulation d’animaux récemment traités.
Les personnes présentant une hypersensibilité connue à l’éprinomectine doivent éviter tout contact avec ce médicament vétérinaire.
Porter un équipement de protection individuelle comprenant des gants en caoutchouc, des bottes et un vêtement imperméable pendant la manipulation du médicament vétérinaire.
En cas de contact accidentel avec la peau, laver immédiatement la zone atteinte avec du savon et de l’eau. En cas de projection accidentelle dans les yeux, rincer les yeux immédiatement avec de l’eau.
En cas de contamination des vêtements, les enlever dès que possible et les laver avant de les réutiliser.
Ce médicament vétérinaire peut agir sur le système nerveux central en cas d’ingestion accidentelle. Éviter toute ingestion accidentelle du produit, y compris par contact main-bouche. En cas d’ingestion, rincer la bouche avec de l’eau et demander un avis médical.
Ne pas fumer, boire ou manger pendant la manipulation du produit.
Se laver les mains après utilisation.
Précautions particulières concernant la protection de l'environnement
L’éprinomectine est très toxique pour les organismes aquatiques, elle est persistante dans les sols et elle peut s’accumuler dans les sédiments. L’éprinomectine présente dans les fèces des animaux traités mis en pâturage peut temporairement réduire l’abondance des organismes coprophages. Après traitement des bovins, des taux potentiellement toxiques d’éprinomectine pour les mouches du fumier peuvent être excrétés pendant plus de 4 semaines après le traitement et peuvent réduire leur abondance pendant cette période. En cas de traitements répétés par l’éprinomectine (et comme avec tout anthelminthique de la même classe), il est recommandé de ne pas traiter chaque fois les animaux sur le même pâturage pour permettre à la faune coprophage de se reconstituer.
L’éprinomectine est intrinsèquement toxique pour les organismes aquatiques. Le produit doit uniquement être utilisé conformément aux instructions figurant sur l’étiquette. Compte tenu du profil d’excrétion de l’éprinomectine administrée en pour-on, les animaux traités ne doivent pas avoir accès aux cours d’eau pendant les 7 premiers jours après le traitement.
Autres précautions
3.6 Effets indésirables
Bovins :
Très rare (< 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Réaction au site d’application (léchage, irritation, sécheresse cutanée et présence de squames au site d’application) *
|
*Transitoire.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation:
Les études menées sur les animaux de laboratoire (rat, lapin) n’ont pas mis en évidence d’effets tératogènes ou embryotoxiques de l’éprinomectine aux doses thérapeutiques. L’innocuité du médicament vétérinaire a été établie chez les vaches gestantes et allaitantes.
Fertilité:
L’innocuité du médicament vétérinaire chez les bovins a été établie chez des taureaux reproducteurs.
3.8 Interactions médicamenteuses et autres formes d'interactions
L’éprinomectine se liant fortement aux protéines plasmatiques, il convient d’en tenir compte lors de l’association avec d’autres molécules présentant les mêmes caractéristiques.
3.9 Voies d'administration et posologie
Utilisation pour-on.
Administration topique en une seule application à la dose de 500 µg d’éprinomectine par kg de poids vif, soit 1 mL par 10 kg de poids vif.
Appliquer la solution pour pour-on le long de la ligne du dos de l’animal en une bande étroite qui va du garrot à la base de la queue.

Tous les animaux d’un même groupe doivent être traités en même temps.
Un sous-dosage peut entraîner une utilisation inefficace et favoriser le développement d’une résistance.
Pour garantir un dosage correct, le poids corporel doit être déterminé aussi précisément que possible. Si les animaux doivent être traités collectivement, des groupes raisonnablement homogènes doivent être constitués, et tous les animaux d’un groupe doivent recevoir la dose correspondant à l’animal le plus lourd.
La précision du dispositif de dosage doit être soigneusement vérifiée.
Mode d’administration :
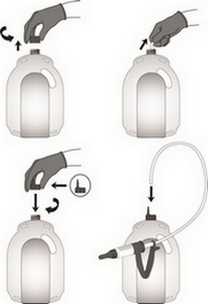
Présentation de 1 L :
Le flacon est équipé d’un système de dosage intégré et comporte deux ouvertures, une en communication avec le flacon et l’autre avec la chambre de distribution (système de dosage).
Dévisser le bouchon et enlever l’opercule de la chambre de distribution (système de dosage intégré permettant d’administrer des doses de 10 mL à 50 mL).
Presser le flacon pour remplir la chambre de distribution avec le volume requis de produit.
Figure 1. Utilisation de la chambre de distribution graduée des flacons de 1 L :

Pour les présentations de 2,5 L et de 5 L :
Utiliser avec un système de dosage approprié, comme un pistolet doseur combiné à un bouchon d’évent.
Dévisser le bouchon simple en polypropylène (PP) et enlever l’opercule de protection du bidon. Visser le bouchon d’évent et vérifier qu’il est bien serré. Raccorder l’embout du bouchon d’évent à la tubulure d’un pistolet doseur.
Suivre les instructions du fabricant du pistolet pour ajuster la dose et pour utiliser et entretenir correctement le pistolet doseur.
Après utilisation, enlever le bouchon d’évent et le remplacer par le bouchon simple en PP.
Replacer le bouchon d’évent dans la boîte en carton jusqu’à la prochaine utilisation.
Figure 2. Raccordement de pistolet doseur aux bidons de 2,5 L ou de 5 L :
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Aucun signe de toxicité n’a été observé après l’administration du produit jusqu’à 5 fois la dose recommandée. Il n’existe aucun antidote spécifique.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Viande et abats : 15 jours.
Lait : zéro heure.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QP54AA04.
4.2 Propriétés pharmacodynamiques
L’éprinomectine est une molécule à activité endectocide de la classe des lactones macrocycliques. Les composés de cette classe ont une forte affinité pour les canaux à ions chlorures glutamate-dépendants présents dans les cellules nerveuses ou musculaires des invertébrés. Ces composés se lient de manière sélective à ces canaux, entraînant une augmentation de la perméabilité membranaire aux ions chlorures associée à une hyperpolarisation de la cellule nerveuse ou musculaire provoquant une paralysie et la mort du parasite.
Les composés de cette classe peuvent également interagir avec des canaux chlorures ligands-dépendants, par exemple ceux qui sont activés par le neurotransmetteur GABA (acide gamma-aminobutyrique).
4.3 Propriétés pharmacocinétiques
Chez les bovins, la biodisponibilité de l’éprinomectine en application topique est d’environ 30 %, la majorité de l’absorption survenant dans les 10 jours après le traitement. L’éprinomectine est fortement liée aux protéines plasmatiques (99 %). L’éprinomectine n’est pas fortement métabolisée chez les bovins après administration par voie topique.
Les fèces représentent la voie principale d’élimination.
Propriétés environnementales
Comme d’autres lactones macrocycliques, l’éprinomectine peut avoir des effets néfastes chez des organismes non-cibles (voir rubrique 3.5 « Précautions particulières concernant la protection de l’environnement »).
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
Durée de conservation après première ouverture du conditionnement primaire : 18 mois (et avant la date de péremption).
5.3 Précautions particulières de conservation
Flacons de 1 L : Conserver le flacon dans l’emballage extérieur de façon à le protéger de la lumière.
Bidons de 2,5 L ou de 5 L : Pas de précautions particulières de conservation.
Une fois les conditionnements ouverts, les conserver en position verticale.
5.4 Nature et composition du conditionnement primaire
Flacon polyéthylène haute densité équipé d'une chambre de distribution intégrée graduée tous les 10 mL jusqu'à 50 mL
Opercule aluminium/polyéthylène
Bouchon à vis polyéthylène haute densité (flacon de 1 L)
Bidon polyéthylène haute densité blanc
Opercule copolymère éthylène-acide méthacrylique-zinc
Bouchon à vis polypropylène (bidons de 2,5 L et 5 L)
Bouchon d'évent à vis polypropylène (bidons de 2,5 L et 5 L)
Le pistolet doseur comprend un tube PVC et une chambre de distribution plastique.
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Le médicament vétérinaire est dangereux pour les poissons et les organismes aquatiques. Ne pas contaminer des cours d’eau ou des fossés avec le produit ou des conditionnements vides.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
BIMEDA ANIMAL HEALTH
UNIT 2/3/4 AIRTON CLOSE
TALLAGHT
DUBLIN 24 DUBLIN
IRLANDE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/0416250 2/2018
Boîte de 1 flacon de 1 L
Boîte de 1 bidon de 2,5 L
Boîte de 1 bidon de 5 L
Boîte de 3 bidons de 2,5 L et de 1 pistolet doseur
Boîte de 2 bidons de 5 L et de 1 pistolet doseur
Boîte de 2 bidons de 5 L + 1 bidon de 2,5 L et de 1 pistolet doseur
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
11/05/2018 - 28/01/2022
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
22/01/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).