CARPORAL 40 MG COMPRIMES POUR CHIENS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé contient : |
|
|
|
Substance(s) active(s) : |
|
Carprofène | 40 mg |
Excipient(s) :
Composition qualitative en excipients et autres composants |
Lactose monohydraté |
Carboxyméthylamidon sodique de type A |
Amidon de maïs |
Talc |
Cellulose en poudre |
Amidon prégélatinisé |
Silice colloïdale anhydre |
Béhénate de calcium |
Levure de bière |
Arôme bœuf artificiel |
Comprimé aromatisé rond et convexe, marron clair avec des taches brunes et une barre de sécabilité en croix sur une face.
Les comprimés peuvent être divisés en 2 ou 4 parties égales.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chiens.
3.2 Indications d'utilisation pour chaque espèce cible
Réduction de l’inflammation et de la douleur dues à des troubles musculo-squelettiques et à des affections articulaires dégénératives. En relais de l’analgésie parentérale dans la prise en charge de la douleur post-opératoire.
3.3 Contre-indications
Ne pas utiliser chez les chats.
Ne pas utiliser chez les chiennes en gestation ou en lactation.
Ne pas utiliser chez les chiots de moins de 4 mois.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
Ne pas utiliser chez les chiens présentant une affection cardiaque, hépatique ou rénale, lors d’une suspicion d’ulcération ou d’hémorragie gastro-intestinale, ou lors d’une dyscrasie sanguine avérée.
3.4 Mises en garde particulières
Aucune.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
L’utilisation chez le chien âgé peut entraîner un risque supplémentaire.
S’il n’est pas possible d’éviter une telle utilisation, l’animal devra faire l’objet d’une prise en charge clinique attentive.
Éviter l'administration en cas de déshydratation, d’hypovolémie ou d’hypotension car le risque de toxicité rénale peut être augmenté.
Les AINS (anti-inflammatoires non stéroïdiens) peuvent provoquer une inhibition de la phagocytose et dans le traitement d’états inflammatoires associés à une infection bactérienne, il convient donc d’initier un traitement antimicrobien concomitant.
Les comprimés sont aromatisés. Conserver les comprimés hors de portée des animaux pour éviter toute ingestion accidentelle.
Voir la rubrique 3.8.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l'étiquette. Se laver les mains après manipulation du médicament vétérinaire.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Chiens :
Rare (1 à 10 animaux / 10 000 animaux traités): | Trouble rénal Trouble hépatiqueb |
Très rare ( < 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Vomissementsa, selles molles, diarrhéea, saignement fécala Léthargiea,perte d’appétita |
a Ces effets indésirables apparaissent généralement durant la première semaine de traitement. Ils sont le plus souvent transitoires et disparaissent après la fin du traitement, mais peuvent, dans de très rares cas, être graves ou mortels.
b Effet idiosyncrasique
En cas d’apparition d’effets indésirables, il convient d’interrompre le traitement et de demander conseil à un vétérinaire.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Les études de laboratoire sur le rat et le lapin ont mis en évidence des effets fœtotoxiques du carprofène à des doses proches de la dose thérapeutique. L’innocuité du médicament vétérinaire n’a pas été établie en cas de gestation et de lactation.
Voir la rubrique 3.3.
3.8 Interactions médicamenteuses et autres formes d'interactions
Ne pas administrer d’autres AINS et glucocorticoïdes en même temps ou pendant 24 heures après l’administration du médicament vétérinaire. Le carprofène se liant avec une haute affinité aux protéines plasmatiques, il peut entrer en compétition avec d’autres médicaments montrant la même affinité, ce qui peut conduire à des effets toxiques.
L’administration en même temps que des médicaments potentiellement néphrotoxiques est à éviter.
3.9 Voies d'administration et posologie
Voie orale.
Afin de garantir une posologie appropriée et d’éviter un surdosage, le poids corporel doit être déterminé aussi précisément que possible.
Posologie :
2 - 4 mg de carprofène par kg de poids corporel et par jour.
Pour réduire l’inflammation et la douleur dues à des troubles musculo-squelettiques et à des affections articulaires dégénératives : une dose initiale de 4 mg de carprofène par kg de poids corporel par jour, en une prise quotidienne unique ou bien en deux doses identiques ; en fonction de la réponse clinique, la dose peut être réduite à 2 mg de carprofène/kg de poids corporel/jour, en une dose unique. La durée du traitement dépend de la réponse clinique observée. Pour un traitement supérieur à 14 jours, le chien doit être examiné régulièrement par un vétérinaire.
Ne pas dépasser la posologie recommandée.
Pour étendre la couverture analgésique et anti-inflammatoire post-opératoire : un traitement pré-opératoire par voie parentérale avec une solution injectable de carprofène peut être suivi par l'administration de comprimés de carprofène à raison de 4 mg/kg de poids corporel/jour pendant une durée pouvant aller jusqu’à 5 jours.
Le tableau suivant a été conçu pour servir de guide afin d’administrer le médicament vétérinaire à la dose de 4 mg de carprofène par kg de poids corporel par jour.

Les comprimés peuvent être divisés en 2 ou 4 parties égales pour permettre l’administration de la dose exacte. Placer le comprimé sur une surface plane, avec la face portant la barre de sécabilité vers le haut et la face convexe (arrondie) orientée vers la surface plane.
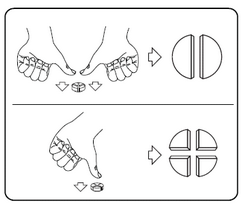
Moitiés : appuyer avec les pouces sur les deux côtés du comprimé.
Quarts : appuyer avec les pouces au milieu du comprimé.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Aucun signe de toxicité n’est apparu lorsque les chiens ont été traités avec du carprofène à des doses allant jusqu’à 6 mg/kg de poids corporel deux fois par jour pendant 7 jours (soit 3 fois la dose recommandée la plus élevée de 4 mg/par kg de poids corporel) et 6 mg/kg de poids corporel une fois par jour pendant 7 jours supplémentaires (soit 1,5 fois la dose recommandée la plus élevée de 4 mg/kg de poids corporel).
Il n’existe pas d’antidote spécifique pour un surdosage de carprofène, mais un traitement symptomatique général, tel que celui appliqué aux surdosages cliniques avec les AINS, doit être mis en place.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QM01AE91
4.2 Propriétés pharmacodynamiques
Le carprofène est un AINS. Il est dérivé de l’acide phénylpropionique et appartient au groupe des acides 2-arylpropioniques des AINS. Il contient un centre chiral en C2 du radical propionique et, de ce fait, il existe sous deux formes de stéréoisomères : les énantiomères S (+) et R (-). Chez les chiens, il n’y a pas d’inversion chirale entre les énantiomères in vivo.
Le carprofène possède des propriétés anti-inflammatoires, analgésiques et antipyrétiques. Comme la plupart des autres AINS, le carprofène est un inhibiteur de la cyclooxygénase dans la cascade de l’acide arachidonique.
Toutefois, l’inhibition de la synthèse des prostaglandines par le carprofène est légère par rapport à son action anti-inflammatoire et analgésique. Le mode d'action précis du carprofène n'est pas connu avec certitude.
4.3 Propriétés pharmacocinétiques
Chez les chiens, l’absorption du carprofène est rapide (Tmax = 2,0 h) après administration orale. La Cmax est de 28,67 µg/mL. Le volume de distribution est faible et le carprofène est fortement lié aux protéines plasmatiques. La biotransformation du carprofène a lieu dans le foie, où sont formés l’ester d’acide glucuronique et deux diastéréoisomères 1-O-acyl-β-D-glucuronide. Ils sont sécrétés dans les canaux biliaires et excrétés dans les fèces.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
Sans objet.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
Un comprimé qui a été divisé doit être utilisé dans les 3 jours.
5.3 Précautions particulières de conservation
Toute partie non utilisée d’un comprimé doit être remise dans la plaquette ouverte de façon à le protéger de la lumière.
Une plaquette thermoformée non ouverte ne nécessite pas de conditions particulières de conservation.
5.4 Nature et composition du conditionnement primaire
Plaquette thermoformée polyamide-aluminium / aluminium / PVC
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
LE VET. BEHEER B.V.
WILGENWEG 7
3421 TV OUDEWATER (UTRECHT)
PAYS-BAS
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/3152285 2/2015
Boîte de 1 plaquette thermoformée de 10 comprimés quadrisécables
Boîte de 2 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 3 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 4 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 5 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 6 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 7 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 8 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 9 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 10 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 25 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 50 plaquettes thermoformées de 10 comprimés quadrisécables
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
24/06/2015 - 20/05/2020
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
13/05/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).