CEFABACTIN 500 MG COMPRIMES POUR CHIENS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un comprimé contient : |
|
|
|
Substance(s) active(s) : |
|
Céfalexine (sous forme de monohydrate) | 500 mg |
Excipient(s) :
Composition qualitative en excipients et autres composants |
Lactose monohydraté |
Amidon de pomme de terre |
Silice colloïdale monohydratée |
Levure de bière |
Arôme poulet |
Stéarate de magnésium |
Comprimé aromatisé marron clair avec des taches marron, de forme ronde et convexe, avec une barre de sécabilité sur une face en forme de croix.
Les comprimés peuvent être divisés en 2 ou 4 parties égales.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chiens.
3.2 Indications d'utilisation pour chaque espèce cible
Pour le traitement des :
- Infections des voies respiratoires – notamment la bronchopneumonie – causées par Staphylococcus aureus, Streptococcus spp., Escherichia coli et Klebsiella spp.,
- Infections urinaires causées par Escherichia coli, Proteus spp. et Staphylococcus spp.,
- Infections cutanées causées par Staphylococcus spp.
3.3 Contre-indications
Ne pas utiliser en cas d’hypersensibilité à la substance active, à d’autres céphalosporines, à d’autres substances de la classe des bêta-lactamines ou à l’un des excipients.
Ne pas utiliser en cas de résistance aux céphalosporines ou aux pénicillines.
Ne pas utiliser chez les lapins, les cochons d’Inde, les hamsters et les gerbilles.
3.4 Mises en garde particulières
Aucune.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
En raison de la variabilité (temporelle, géographique) probable de l’apparition de bactéries résistantes à la céfalexine, des prélèvements d’échantillons bactériologiques et des tests de sensibilité sont recommandés.
Le médicament vétérinaire doit être utilisé conformément aux politiques officielles, nationales et régionales concernant l’antibiothérapie.
Les politiques officielles, nationales et régionales concernant l’antibiothérapie doivent être prises en considération lors de l’utilisation de ce médicament vétérinaire.
Une utilisation du médicament vétérinaire en dehors des recommandations du RCP peut augmenter la prévalence de bactéries résistantes à la céfalexine et peut diminuer l’efficacité du traitement avec d’autres antibiotiques de la classe des bêta-lactamines en raison de possibles résistances croisées.
En cas d’insuffisance rénale chronique, la posologie doit être réduite ou l’intervalle d’administration doit être augmenté.
Les comprimés sont aromatisés. Afin d’éviter toute ingestion accidentelle, conserver les comprimés hors de la portée des animaux.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Les pénicillines et les céphalosporines peuvent entraîner des réactions d’hypersensibilité (allergies), après injection, inhalation, ingestion ou contact cutanée. Une hypersensibilité à la pénicilline peut entraîner des réactions croisées aux céphalosporines et inversement. Les réactions allergiques à ces substances peuvent parfois être graves. Ne pas manipuler ce médicament vétérinaire si vous savez que vous êtes sensibles à de telles substances ou s’il vous a été conseillé de ne pas être en contact avec ces substances.
Manipulez ce médicament vétérinaire avec une grande prudence pour éviter toute exposition, en prenant toutes les précautions recommandées. Si vous développez des symptômes suite à une exposition au produit telles que des éruptions cutanées, demandez immédiatement conseil à un médecin et montrez-lui cet avertissement. Un gonflement du visage, des lèvres ou des yeux, tout comme des difficultés respiratoires, sont des symptômes plus graves qui nécessiteront une prise en charge médicale d’urgence.
Pour éviter toute ingestion accidentelle du médicament vétérinaire par un enfant, les fractions de comprimés ou les comprimés inutilisés doivent être replacés dans l’alvéole ouverte de la plaquette qui doit être rangée dans la boîte.
En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Se laver les mains après utilisation.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Chiens :
Rare (1 à 10 animaux / 10 000 animaux traités) : | Réaction d’hypersensibilitéa |
Très rare ( < 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Vomissementsb, diarrhéesb, Léthargie |
a Le traitement doit être interrompu.
b En cas de récurrence, le traitement doit être interrompu et il sera conseillé de consulter un vétérinaire.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation :
Les études de laboratoire sur les rats et les souris n’ont pas mis en évidence d’effets tératogènes.
L’innocuité du médicament vétérinaire chez les chiens n’a pas été établie en cas de gestation et de lactation. L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
3.8 Interactions médicamenteuses et autres formes d'interactions
Afin de s’assurer de l’efficacité du traitement, le médicament vétérinaire ne doit pas être utilisé en association avec des antibiotiques bactériostatiques (macrolides, sulfonamides et tétracyclines). Une utilisation des céphalosporines de première génération en concomitance avec des aminoglycosides ou certains diurétiques – comme le furosémide – peut augmenter les risques de néphrotoxicité.
3.9 Voies d'administration et posologie
Voie orale.
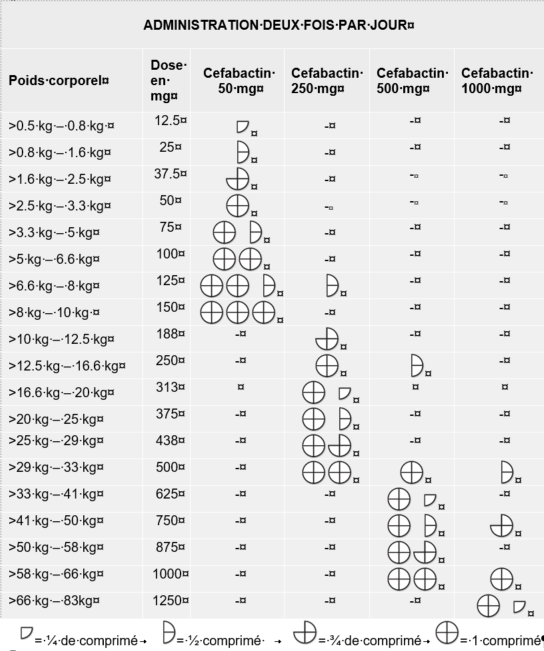
La dose recommandée est de 15-30 mg de céfalexine par kg de poids corporel, deux fois par jour, pendant au moins 5 jours consécutifs. Un cycle de traitement prolongé peut être prescrit par le vétérinaire responsable de l’animal, par exemple, en cas d’infection urinaire ou de dermatite bactérienne.
Afin de garantir une posologie appropriée, le poids corporel doit être déterminé aussi précisément que possible afin d’éviter tout sous-dosage.
Le tableau suivant sert de guide à l’administration du médicament vétérinaire à une dose de 15 mg de céfalexine par kg de poids corporel, deux fois par jour.
Les comprimés peuvent être divisés en 2 ou 4 parties égales pour garantir un dosage précis. Poser le comprimé sur une surface plane, avec la face dotée de la barre de cassure vers le haut.
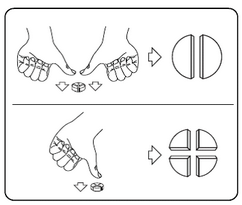
Moitiés de comprimé : appuyer sur les deux extrémités du comprimé à l’aide des pouces.
Quarts de comprimé : appuyer sur le milieu du comprimé à l’aide du pouce.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Aucun effet indésirable autre que ceux mentionnés dans la rubrique 3.6 n’est connu.
En cas de surdosage, il convient d’instaurer un traitement symptomatique.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QJ01DB01
4.2 Propriétés pharmacodynamiques
Le mécanisme d’action des céphalosporines ressemble à celui des pénicillines, et en particulier à celui de l’ampicilline (anneau bêta-lactame en commun). Les céphalosporines ont notamment un effet bactéricide temps-dépendant. Elles se lient irréversiblement aux « protéines liant la pénicilline », des enzymes nécessaires pour le couplage croisé des brins de peptidoglycane pendant la synthèse de la paroi des cellules bactériennes. Ceci nuit à la réticulation des chaînes de peptidoglycane nécessaires pour rendre les cellules bactériennes fortes et résistantes, et entraîne une croissance cellulaire anormale, ainsi que la lyse cellulaire. La céfalexine agit tant contre les bactéries à Gram positif, que contre certaines des bactéries à Gram négatif.
Les seuils d’efficacité de la céfalotine établis par le Clinical and Laboratory Standards Institute (CLSI) suivants sont disponibles pour les chiens (CLSI, VET01S ed. 5, Novembre 2020).
La céfalotine peut être utilisée comme un indicateur de céphalosporines de première génération.
Infections cutanées et des tissus mous
Espèces bactériennes | Sensible | Résistant |
Staphylococcus aureus et Staphylococcus pseudintermedius | ≤ 2 µg/mL | ≥ 4 µg/mL |
Streptococcus spp. et E. coli | ≤ 2 µg/mL | ≥ 8 µg/mL |
Infections urinaires
Espèces bactériennes | Sensible | Résistant |
E. coli, Klebsiella pneumoniae et Proteus mirabilis | ≤ 16 µg/mL | ≥ 32 µg/mL |
Comme pour les pénicillines, la résistance à la céfalexine peut être due à l’un des mécanismes de résistance suivants : la production de diverses bêta-lactamases, codées ou non par des plasmides, ou résultant de mutations développées après plusieurs étapes. Dans le premier cas, il y a pratiquement toujours une résistance croisée avec l’ampicilline ; dans les autres cas, une résistance croisée partielle ou complète à toutes les pénicillines et céphalosporines est observée. Inversement, les Staphylocoques résistants à la méthicilline ne sont pas sensibles aux céphalosporines.
4.3 Propriétés pharmacocinétiques
Après administration du monohydrate de céfalexine, la céfalexine est rapidement et presque entièrement absorbée dans le tractus gastro-intestinal. L’absorption est retardée avec l’alimentation (concentrations plasmatiques plus faibles). Le produit est lié à environ 20 % aux protéines plasmatiques.
L’administration d’une dose orale unique de 20 mg de céfalexine par kg de poids corporel, chez les chiens, a entraîné une Tmax d’environ 1 à 1 heure et demi ; une Cmax plasmatique d’environ 15 µg/mL et une demi-vie d’élimination d’environ 2 heures (biodisponibilité = 75 – 80 %). Le volume de distribution est de 1,62 L/kg.
Après absorption, la céfalexine est bien distribuée dans les liquides extracellulaires de l’organisme. Toutefois, le passage des membranes biologiques est limité. Les concentrations de céfalexine sont les plus élevées dans les reins (urine) et la bile, puis dans le foie, les poumons, le cœur, le muscle squelettique et la rate.
Il y a très peu de métabolisme hépatique. L’élimination du médicament se fait presque entièrement par les reins (excrétion tubulaire rénale et filtration glomérulaire). La céfalexine est également excrétée dans la bile à une concentration égale ou légèrement plus élevée que la concentration sanguine.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
Sans objet.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
Durée de conservation des comprimés divisés : 4 jours.
5.3 Précautions particulières de conservation
À conserver à une température ne dépassant pas 25°C.
5.4 Nature et composition du conditionnement primaire
Plaquette thermoformée aluminium-PVC/PE/PVDC
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
LE VET. BEHEER B.V.
WILGENWEG 7
3421 TV OUDEWATER (UTRECHT)
PAYS-BAS
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/9133267 9/2016
Boîte de 1 plaquette thermoformée de 10 comprimés quadrisécables
Boîte de 2 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 3 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 4 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 5 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 6 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 7 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 8 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 9 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 10 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 25 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte en carton contenant 10 boîtes distinctes, contenant chacune 1 plaquette de 10 comprimés
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
21/06/2016 - 25/05/2021
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
11/06/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).