DOXYTAB VET. 400 MG COMPRIMES POUR CHIENS
2. Composition qualitative et quantitative
Un comprimé contient : |
|
|
|
Substance(s) active(s) : |
|
Doxycycline …………………………………………… | 400 mg |
(sous forme d’hyclate) |
|
(équivalant à 461,7 mg d’hyclate de doxycycline) |
|
Pour la liste complète des excipients, voir rubrique « Liste des excipients ».
3. Forme pharmaceutique
Comprimé.
Comprimé jaune moucheté de brun, rond et convexe, avec une barre de sécabilité cruciforme sur une face. Les comprimés peuvent être divisés en 2 ou en 4 parts égales.
4. Informations cliniques
4.1. Espèces cibles
Chiens.
4.2. Indications d'utilisation, en spécifiant les espèces cibles
Traitement des affections suivantes, causées par des bactéries sensibles à la doxycycline :
Chez les chiens :
Rhinite causée par Bordetella bronchiseptica et Pasteurella spp. ;
Bronchopneumonie causée par Bordetella spp. et Pasteurella spp. ;
Néphrite interstitielle causée par Leptospira spp. ;
4.3. Contre-indications
Ne pas utiliser en cas d’hypersensibilité aux tétracyclines ou à l’un des excipients.
4.4. Mises en garde particulières à chaque espèce cible
Aucune.
4.5. Précautions particulières d'emploi
i) Précautions particulières d'emploi chez l'animal
Le produit doit être administré avec prudence aux animaux présentant une dysphagie ou atteints de maladies accompagnées de vomissements car l’administration de comprimés d’hyclate de doxycycline a été associée à une érosion œsophagienne.
Afin de réduire la possibilité d’irritation œsophagienne ainsi que d’autres effets secondaires gastro-intestinaux, le produit doit être administré avec la nourriture.
Des précautions particulières doivent être prises lors de l’administration du produit à des animaux atteints d’une maladie du foie car des augmentations des enzymes hépatiques ont été documentées chez certains animaux après un traitement par la doxycycline.
Le produit doit être administré avec précaution aux jeunes animaux car les tétracyclines en tant que classe peuvent provoquer une décoloration permanente des dents lorsqu’elles sont administrées pendant le développement dentaire. Cependant, il est indiqué dans la littérature que la doxycycline est moins susceptible que d’autres tétracyclines de provoquer ces anomalies, en raison de sa capacité réduite à chélater le calcium.
Les comprimés sont aromatisés. Conserver hors de portée des animaux afin d’éviter toute ingestion accidentelle.
En raison de la variabilité probable (temporelle, géographique) de l’apparition de résistance des bactéries à la doxycycline, il est recommandé de réaliser un prélèvement bactériologique et un test de sensibilité. Les politiques antimicrobiennes officielles, nationales et régionales doivent être prises en compte lors de l’utilisation du produit.
L’utilisation du produit en dehors des recommandations du RCP peut augmenter la prévalence de bactéries résistantes à la doxycycline et peut diminuer l’efficacité du traitement avec d’autres tétracyclines, en raison de possibles résistances croisées.
ii) Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Ce produit peut provoquer des réactions d’hypersensibilité.
Les personnes présentant une hypersensibilité connue aux tétracyclines doivent éviter tout contact avec le médicament vétérinaire.
Si vous développez après une exposition des symptômes tels qu’une éruption cutanée, demandez immédiatement conseil à un médecin et montrez-lui la notice.
Ce produit peut provoquer des troubles gastro-intestinaux graves après ingestion, en particulier chez les enfants. Pour éviter une ingestion accidentelle, remettre les morceaux de comprimés inutilisés doivent être réinsérés dans l’alvéole ouverte de la plaquette, et remettre cette dernière dans la boîte en carton qui doit être rangée dans un endroit sûr hors de la vue et de la portée d’enfants. En cas d’ingestion accidentelle, consultez immédiatement un médecin et lui montrer la notice ou l’étiquette.
Se laver les mains après utilisation.
iii) Autres précautions
Aucune.
4.6. Effets indésirables (fréquence et gravité)
Des troubles gastro-intestinaux tels que vomissements, diarrhées et œsophagite, ont été signalés comme effets secondaires après un traitement à long terme par la doxycycline.
Chez les animaux très jeunes, une décoloration des dents peut se produire par formation d’un complexe tétracycline-phosphate de calcium.
Des réactions d’hypersensibilité, une photosensibilité et, dans des cas exceptionnels, une photodermatite peuvent apparaître après exposition à une lumière du jour intense.
Un retard de la croissance du squelette a été observé chez les jeunes animaux (réversible lors de l’arrêt du traitement) avec d’autres tétracyclines et pourrait se produire après administration de doxycycline.
4.7. Utilisation en cas de gestation, de lactation ou de ponte
L’innocuité du médicament vétérinaire n’a pas été établie en cas de gestation et de lactation. Les tétracyclines en tant que classe peuvent retarder le développement du squelette fœtal (totalement réversible) et provoquer une décoloration des dents de lait. Cependant, les données probantes issues de la littérature relative aux humains suggèrent que la doxycycline est moins susceptible de provoquer ces anomalies que d’autres tétracyclines. L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
4.8. Interactions médicamenteuses et autres formes d'interactions
Ne pas administrer de façon concomitante avec des antibiotiques bactéricides comme les pénicillines et les céphalosporines.
Les absorbants oraux et les substances contenant des cations multivalents, tels que les antiacides et les sels de fer, ne doivent pas être utilisés dans les 3 heures précédant et suivant l’administration de la doxycycline car ils réduisent la disponibilité de la doxycycline. La demi-vie de la doxycycline est réduite par l’administration concomitante de médicaments antiépileptiques tels que le phénobarbital et la phénytoïne.
4.9. Posologie et voie d'administration
Voie orale.
La posologie recommandée est de 10 mg de doxycycline par kg de poids corporel par jour. La dose journalière peut être administrée en deux fois par jour (soit 5 mg/kg de poids corporel, deux fois par jour).
Dans la majorité des cas, une réponse au traitement est généralement obtenue entre 5 et 7 jours de traitement.
Le traitement doit se poursuivre pendant 2 à 3 jours après la guérison clinique des infections aiguës. Dans les cas chroniques ou réfractaires, un traitement plus long, jusqu’à 14 jours, peut être nécessaire.
Chez les chiens atteints de néphrite interstitielle due à une leptospirose, un traitement de 14 jours est recommandé.
Pour assurer un dosage correct, le poids corporel doit être déterminé aussi précisément que possible pour éviter le sous-dosage.
Les comprimés doivent être administrés avec la nourriture (voir rubrique « Précautions particulières d’emploi »).
Il convient d’utiliser la taille de comprimés la plus appropriée afin de réduire au minimum le nombre de morceaux de comprimés à conserver jusqu’à l’administration suivante.
Les comprimés peuvent être divisés en 2 ou en 4 parts égales pour assurer un dosage précis. Placez le comprimé sur une surface plane, avec son côté rainuré vers le haut et le côté convexe (arrondi) face à la surface.
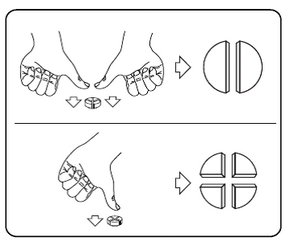
2 parts égales : appuyez vers le bas avec vos pouces sur les deux côtés du comprimé.
4 parts égales : appuyez vers le bas avec votre pouce au milieu du comprimé.
Remettre tous les morceaux divisés dans la plaquette thermoformée. Les morceaux de comprimés doivent être utilisés lors de l’administration suivante. Les morceaux de comprimés restant après la dernière administration du produit doivent être jetés.
4.10. Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
En cas de surdosage, aucun autre symptôme que ceux mentionnés à la rubrique « Effets indésirables (fréquence et gravité) » n’est attendu.
4.11. Temps d'attente
Sans objet.
5. Propriétés pharmacologiques
Groupe pharmacothérapeutique : antibactérien à usage systémique, Tétracyclines.
Code ATC-vet : QJ01AA02.
5.1. Propriétés pharmacodynamiques
La doxycycline est une tétracycline de deuxième génération. Le produit est principalement bactériostatique ; il inhibe la synthèse des protéines bactériennes en bloquant la liaison de l’ARN de transfert au complexe ARN messager-ribosome.
La résistance est principalement médiée par des pompes à efflux ou des protéines de protection ribosomique.
La résistance croisée parmi les tétracyclines est fréquente mais dépend des mécanismes de résistance: c’est-à-dire que la mutation dans les pompes à efflux qui induit la résistance à la tétracycline peut encore être sensible à la doxycycline. Cependant, l’induction des protéines de protection ribosomique confère une résistance croisée à la doxycycline.
Espèce/groupe et origine bactérie | MIC90 (µg/mL) | Résistant# (%) |
Pasteurella chez le chien (FR 2017) |
| 3 (N=101) |
B. bronchiseptica chez le chien et le chat (DE 2016/2017) | 1,0 |
|
# = 100 – Susceptible (%), concentration critique pour la sensibilité ≤ 4 µg/mL, basé sur les recommandations du CA-SFM français (Comité de l’Antibiogramme de la Société Française de Microbiologie).
N = nombre total de souches testées.
5.2. Caractéristiques pharmacocinétiques
Après administration orale, la doxycycline est principalement absorbée au niveau du duodénum et du jéjunum. Après administration orale, la biodisponibilité est supérieure à 50 %.
Chez le chien, la concentration plasmatique maximale, Cmax de 1710 ng/mL, a été atteinte entre 0,5 et 6 heures après administration de 10 mg/kg de poids corporel pendant l’alimentation. Chez certains chiens, un deuxième pic plasmatique (variable en hauteur) a été observé. L’AUCt moyenne était de 26300 h.ng/mL. La demi-vie estimée, basée sur une quantité limitée de chiens seulement, était de 8,9 heures.
La doxycycline est largement distribuée dans tout le corps et peut s’accumuler dans les cellules, par exemple dans les leucocytes. Elle se dépose dans le tissu osseux actif et dans les dents. La doxycycline pénètre mieux dans le liquide céphalo-rachidien par rapport aux plus anciennes tétracyclines. La doxycycline est principalement éliminée via les fèces par excrétion intestinale directe et, dans une moindre mesure, par excrétion glomérulaire et sécrétion biliaire.
6. Informations pharmaceutiques
6.1. Liste des excipients
Carboxyméthylamidon sodique type A
Silice colloïdale hydratée
Cellulose microcristalline
Lactose monohydraté
Arôme poulet
Stéarate de magnésium
6.2. Incompatibilités majeures
Sans objet.
6.3. Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 4 ans.
6.4. Précautions particulières de conservation
Ce médicament vétérinaire ne nécessite pas de conditions de conservation particulières.
Conserver la plaquette thermoformée dans le carton extérieur. Toute portion restante de comprimés divisés doit être replacée dans la plaquette thermoformée ouverte et administrée lors de la prochaine administration.
6.5. Nature et composition du conditionnement primaire
Plaquette thermoformée aluminium - PVC/PE/PVDC
6.6. Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
7. Titulaire de l'autorisation de mise sur le marché
CP-PHARMA HANDELSGESELLSCHAFT MBH
OSTLANDRING 13
31303 BURGDORF
ALLEMAGNE
8. Numéro(s) d'autorisation de mise sur le marché
FR/V/0873920 5/2020
Boîte de 3 plaquettes thermoformées de 10 comprimés
Boîte de 5 plaquettes thermoformées de 10 comprimés
Boîte de 10 plaquettes thermoformées de 10 comprimés
Boîte de 1 plaquette thermoformée de 30 comprimés
Boîte de 5 plaquettes thermoformées de 30 comprimés
Boîte de 10 plaquettes thermoformées de 30 comprimés
Toutes les présentations peuvent ne pas être commercialisées.
9. Date de première autorisation/renouvellement de l'autorisation
04/06/2020
10. Date de mise à jour du texte
09/02/2024