EKYFLOGYL 1,8 MG/ML + 8,7 MG/ML GEL POUR CHEVAUX
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un mL contient : |
|
|
|
Substances actives: |
|
Prednisolone (sous forme d’acétate) …………………… | 1,8 mg |
(Équivalant à 2 mg d’acétate de prednisolone) |
|
Lidocaïne (sous forme de chlorhydrate monohydraté) … | 8,7 mg |
Excipients :
Composition qualitative en excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Diméthylsulfoxyde | 968 mg |
Hydroxyéthylcellulose |
|
Eau purifiée |
|
Gel visqueux clair.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chevaux.
3.2 Indications d'utilisation pour chaque espèce cible
Chez les chevaux :
- Réduction de la douleur et de l’inflammation associées aux troubles musculo-squelettiques localisés.
3.3 Contre-indications
Ne pas utiliser en cas d'hypersensibilité aux substances actives ou à l'un des excipients.
Voir la rubrique « Utilisation en cas de gestation, de lactation ou de ponte ».
Ne pas utiliser chez les chevaux atteints d'une maladie hépatique ou rénale.
Ne pas utiliser chez les chevaux atteints d'infections virales ou fongiques ou chez les chevaux immunodéprimés.
3.4 Mises en garde particulières
Aucune.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Ce médicament vétérinaire ne doit pas être utilisé sur une peau irritée ou présentant des lésions.
Éviter toute ingestion orale du médicament vétérinaire par les animaux traités ou les animaux ayant été en contact avec des animaux traités.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
- Ce médicament vétérinaire peut provoquer des réactions allergiques. Les personnes présentant une hypersensibilité connue à la prednisolone, à la lidocaïne, à d’autres anesthésiques locaux ou à l'un des excipients ne doivent pas manipuler le médicament vétérinaire.
- La prednisolone peut être nocive pour le fœtus. Il est donc déconseillé aux femmes enceintes de manipuler ce médicament vétérinaire.
- Ce médicament vétérinaire peut-être nocif après exposition cutanée et orale. La lidocaïne peut former des métabolites génotoxiques chez les humains. Une étude toxicologique à long terme chez le rat a montré que ces métabolites peuvent également induire des effets cancérogènes à fortes doses. Le médicament vétérinaire est également irritant pour la peau (réactions incluant érythème et prurit) et pour les yeux.
- Éviter tout contact avec la peau, les yeux et la bouche, y compris le contact main-bouche et le contact main-à-yeux. Se laver les mains après usage. En cas de contact accidentel avec la peau ou les yeux, rincer abondamment à l'eau.
- Porter un équipement de protection individuelle composé de gants de protection imperméables à usage unique pour manipuler le médicament vétérinaire ou toucher la zone traitée.
- Empêcher les enfants de toucher le cheval traité pendant la période de traitement et 12 jours après la fin du traitement.
- Ne pas toucher la zone traitée. Si cela s'avère nécessaire pour prodiguer les soins au cheval, porter des gants de protection imperméables à usage unique.
- En cas d'ingestion accidentelle ou d'irritation prolongée de la peau ou des yeux, consulter immédiatement un médecin et lui montrer la notice ou l'étiquette.
- Le matériel ou les instruments supplémentaires utilisés pour appliquer le médicament vétérinaire, comme un pinceau, doivent être nettoyés minutieusement ou éliminés conformément aux exigences locales.
- Conserver le flacon avec la pompe doseuse dans l’emballage extérieur et dans un endroit sûr, hors de la vue et de la portée des enfants, jusqu'au moment de l'utilisation. Le flacon doit être verrouillé après chaque utilisation (voir détails à la rubrique « Posologie et voie d'administration »).
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Très rare (< 1 animal / 10 000 animaux traités, y compris les cas isolés): | Réactions au site d’application (douleur, chaleur, perte de poils, squamosis cutané, brûlures, gonflement) |
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation:
Des études sur des animaux de laboratoire ont mis en évidence les effets embryotoxiques de la prednisolone.
La lidocaïne pénètre la barrière placentaire et peut avoir des effets neurotoxiques et cardiorespiratoires chez le fœtus et le nouveau-né. L'innocuité du médicament vétérinaire pour les animaux cibles n'a pas été évaluée pendant la gestation ni la lactation.
Ne pas utiliser le médicament vétérinaire chez les juments en gestation ou en lactation.
3.8 Interactions médicamenteuses et autres formes d'interactions
Ne pas utiliser avec d'autres produits, notamment des produits topiques sur la zone traitée.
3.9 Voies d'administration et posologie
Voie cutanée. Appliquer le médicament vétérinaire sur une zone localisée de la lésion sous-jacente à l’aide d’un pinceau (ou assimilé). Au besoin, un pansement non compressif peut être appliqué pour couvrir la zone traitée. Appliquer 10 à 30 mL deux fois par jour, soit 6 à 18 doses de la pompe doseuse, selon la nature de la lésion.

La pompe doit être amorcée deux fois avant utilisation.
Poursuivre le traitement jusqu'à la guérison sans toutefois le prolonger au-delà de 12 jours.
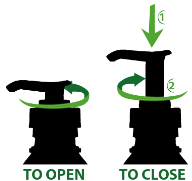
Pour ouvrir le flacon, tourner le bec distributeur comme indiqué sur le dessus. Après chaque utilisation, fermer le flacon en tournant le bec distributeur dans le sens opposé.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Aucune information disponible.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Viande et abats : 10 jours
Ne pas utiliser chez les animaux producteurs de lait destiné à la consommation humaine.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QM02AX99.
4.2 Propriétés pharmacodynamiques
La prednisolone est un glucocorticoïde de synthèse à action anti-inflammatoire. Elle a des propriétés anti-exsudatives, une action anti-granulomateuse et elle diminue la réaction fibroblastique en stabilisant les membranes cellulaires, elle empêche la destruction cellulaire et donc l'inflammation de la zone considérée. De plus, elle augmente le tonus vasculaire local et produit une diminution de l'œdème. Enfin, elle prévient la dépolymérisation des mucopolysaccharides.
La lidocaïne est un anesthésique local.
Le diméthylsulfoxyde (DMSO) favorise la pénétration transcutanée des substances actives en augmentant la perméabilité cellulaire.
4.3 Propriétés pharmacocinétiques
Aucune information spécifique n'est disponible concernant l'application cutanée du médicament vétérinaire chez le cheval.
Appliquée localement sur la peau intacte, la lidocaïne est absorbée de manière limitée et retardée. Une absorption plus importante de lidocaïne est probable lorsque la fonction de la barrière cutanée est compromise. La lidocaïne est éliminée par métabolisme hépatique en métabolites actifs et inactifs, puis excrétée par les reins. La demi-vie terminale est inférieure à 2 heures pour la plupart des espèces animales.
Appliquée localement sur la peau intacte, la prednisolone est absorbée de manière limitée et retardée. Une absorption plus importante de prednisolone est probable lorsque la fonction de la barrière cutanée est compromise. La prednisolone est métabolisée au niveau hépatique et extra-hépatique (notamment les reins). La demi-vie terminale pour les chevaux est d'environ 3 heures. La molécule mère et ses métabolites sont excrétés dans l'urine.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
En l'absence d'études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d'autres médicaments vétérinaires.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
Durée de conservation après première ouverture du conditionnement primaire : 30 jours.
5.3 Précautions particulières de conservation
À conserver à une température ne dépassant pas 30°C.
Conserver dans l’emballage extérieur de façon à protéger de la lumière.
5.4 Nature et composition du conditionnement primaire
Flacon verre type III brun
Pompe doseuse polyéthylène haute densité/polypropylène munie d'un tube plongeur en polyéthylène basse densité et polypropylène
Bouchon à vis polypropylène
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
AUDEVARD
37-39 RUE DE NEUILLY
92110 CLICHY
FRANCE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/0777108 2/2019
Boîte de 1 flacon de 125 mL
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
24/07/2019 - 28/01/2022
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
05/04/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).