ERADIA 125 MG/ML SUSPENSION BUVABLE POUR CHIENS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un mL contient : |
| ||
|
| ||
Substance(s) active(s) : |
|
| |
Métronidazole | 125 mg |
| |
Excipient(s) :
Composition qualitative en excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Butylhydroxytoluène (E321) | 0.2 mg |
Stéarate d'aluminium | / |
Acide stéarique (E570) | / |
Poudre de foie de volaille | / |
Triglycérides à chaîne moyenne | / |
Suspension huileuse avec des particules brunes visibles.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chiens.
3.2 Indications d'utilisation pour chaque espèce cible
Traitement des infections gastro-intestinales dues à Giardia spp. Et Clostridium spp. (c'est-à-dire C. perfringens ou C. difficile).
Traitement des infections de l’appareil urogénital, de la cavité buccale, de la gorge et de la peau dues à des bactéries anaérobies strictes (par exemple Clostridium spp.) sensibles au métronidazole.
3.3 Contre-indications
Ne pas utiliser en cas de troubles hépatiques.
Ne pas utiliser en cas d'hypersensibilité à la substance active ou à l'un des excipients.
3.4 Mises en garde particulières
Aucune.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
En raison de la probable variabilité (temporelle, géographique) de la survenue de résistances bactériennes au métronidazole, un échantillonnage bactériologique et un test de sensibilité sont recommandés.
Dans la mesure du possible, le médicament vétérinaire devra être utilisé sur la base d'un test de sensibilité.
Les politiques officielles, nationales et régionales, en matière d’utilisation des antibiotiques doivent être prises en compte lors de l'utilisation du médicament vétérinaire.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Le métronidazole présente des propriétés mutagènes et génotoxiques chez les animaux de laboratoire ainsi que chez l'homme. Le métronidazole est un cancérogène confirmé chez les animaux de laboratoire et pourrait avoir des effets cancérigènes chez l'homme. Cependant, les données concernant la cancérogénicité du métronidazole chez l’homme restent insuffisantes.
Le médicament vétérinaire peut provoquer une sensibilisation cutanée. En cas d'hypersensibilité connue au métronidazole ou à d'autres dérivés du nitroimidazole ou à l'un des composants du médicament vétérinaire, éviter tout contact avec le médicament vétérinaire.
Éviter le contact avec la peau ou les muqueuses, y compris le contact main-bouche.
Pour éviter un tel contact, porter des gants imperméables lors de l'administration du médicament vétérinaire et / ou lors de l'administration directement dans la bouche de l'animal.
Ne pas laisser les chiens traités lécher les personnes immédiatement après la prise du médicament.
Se laver les mains après utilisation.
En cas de contact avec la peau, laver soigneusement la zone souillée.
Le métronidazole peut causer des effets (neurologiques) indésirables.
Éviter l'ingestion accidentelle.
Ne pas boire, manger ou fumer lors de l'administration du médicament vétérinaire.
Fermer le flacon immédiatement après l'utilisation pour éviter qu’un enfant ait accès au contenu. Ne pas laisser de seringue contenant la suspension à la vue ou à la portée des enfants. Afin d'empêcher les enfants d'avoir accès à des seringues usagées, conserver les seringues dans leur emballage d'origine après utilisation.
En cas d'ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Avertissements supplémentaires lors de l’administration du médicament vétérinaire dans l’alimentation :
Éviter l'accès des enfants à la nourriture médicamentée du chien. Afin d'empêcher les enfants d'avoir accès à la nourriture médicamentée du chien, verser le médicament sur une partie de l’aliment et attendre que l’animal ait mangé la totalité de l’aliment traité. Donner ensuite le reste de l’aliment. Ne pas administrer le traitement à la vue et en présence des enfants. Tout aliment médicamenté non consommé doit être immédiatement retiré et la gamelle soigneusement lavée. Porter des gants et se laver les mains après l’administration du médicament vétérinaire et du nettoyage de la gamelle contaminée.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Chiens:
Très rare ( < 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Signes neurologiques* |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) | Vomissement
Toxicose hépatique (toxicose du foie)
Neutropénie |
*Particulièrement après un traitement prolongé par métronidazole.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la rubrique « coordonnées » de la notice.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation:
Des études chez des animaux de laboratoire ont montré des résultats contradictoires concernant les effets tératogènes/embryotoxiques du métronidazole. Par conséquent, l'utilisation de ce médicament vétérinaire n'est pas recommandée pendant la gestation.
Lactation:
Le métronidazole est excrété dans le lait et son utilisation n'est donc pas recommandée pendant la lactation.
3.8 Interactions médicamenteuses et autres formes d'interactions
Le métronidazole peut avoir un effet inhibiteur sur la dégradation de certains médicaments dans le foie, tels que la phénytoïne, la ciclosporine et la warfarine.
La cimétidine peut réduire le métabolisme hépatique du métronidazole, aboutissant à une augmentation des concentrations sériques du métronidazole.
Le phénobarbital peut augmenter le métabolisme hépatique du métronidazole, aboutissant à une réduction des concentrations sériques du métronidazole.
3.9 Voies d'administration et posologie
Voie orale.
La dose recommandée est de 50 mg de métronidazole par kg de poids corporel par jour (soit 0,4 mL par kg de poids corporel), de préférence donnée en deux doses égales (soit 25 mg équivalant à 0,2 mL par kg de poids corporel deux fois par jour) pendant 5 à 7 jours.
Pour assurer un dosage correct, le poids corporel de l'animal doit être déterminé aussi précisément que possible pour éviter un sous-dosage et un surdosage.
Le tableau suivant est destiné à servir de guide pour administrer un volume de médicament vétérinaire correspondant à 25 mg / kg deux fois par jour ou à 50 mg / kg une fois par jour.
Exemple de poids corporel (kg) | Volume à administrer deux fois par jour pour 25 mg/kg | Volume à administrer une fois par jour pour 50 mg/kg |
1 | 0,4 mL | |
2 | 0,4 mL | 0,8 mL |
3 | 0,6 mL | 1,2 mL |
4 | 0,8 mL | 1,6 mL |
5 | 1,0 mL | 2,0 mL |
10 | 2,0 mL | 4,0 mL |
15 | 3,0 mL | 6,0 mL |
20 | 4,0 mL | 8,0 mL |
25 | 5,0 mL | 10,0 mL |
30 | 6,0 mL | 12,0 mL |
35 | 7,0 mL | 14,0 mL |
40 | 8,0 mL | 16,0 mL |
Pour les doses nécessitant plus de deux seringues pleines, le dosage doit être réparti en deux administrations par jour afin de minimiser les erreurs de calcul et de dosage.
La suspension orale est livrée dans l'emballage décrit ci-dessous :
[Flacon à bouchon pression]
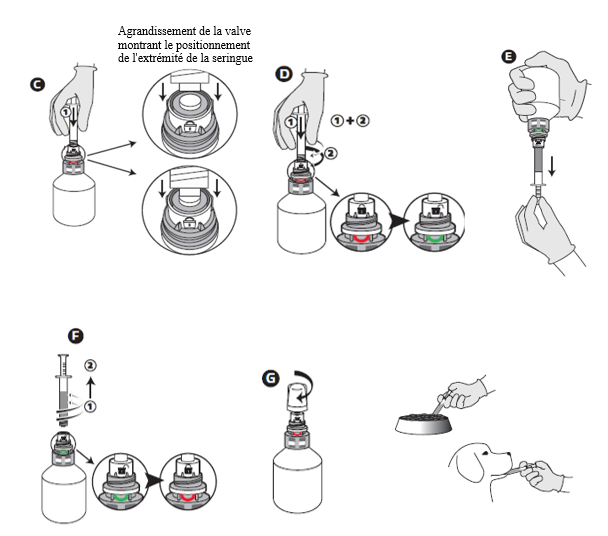
A - Agiter vigoureusement le flacon avant utilisation.
B - Dévisser le bouchon protecteur.
C - Pousser fermement la valve avec l'embout de la seringue.
D - Tout en poussant, tourner la seringue vers la droite (dans le sens des aiguilles d'une montre) jusqu'à l’apparition du sourire vert.
E - Retourner le flacon et prélever le volume prescrit de médicament vétérinaire, avec le flacon maintenu tête en bas.
F - Une fois que le volume correct de médicament vétérinaire a été prélevé dans la seringue, dévisser la seringue du bouchon sans appuyer en tournant vers la gauche (sens contraire des aiguilles d'une montre) jusqu'à la réapparition du sourire rouge, puis continuer à tourner pour retirer la seringue.
Le système peut également être fermé en tournant la molette manuellement.
G - Revisser le capuchon protecteur.
Administrer le médicament vétérinaire en le versant sur une partie de la nourriture ou en l'administrant directement dans la bouche de l'animal. Porter des gants imperméables lors de la manipulation du médicament vétérinaire et/ou de l’administration du médicament vétérinaire dans la bouche de l'animal.
En cas d'administration sur la nourriture, attendre que l'animal ait complètement consommé l'aliment médicamenté, puis donner le reste de la nourriture.

[Flacon avec bouchon à vis]
A-Agiter vigoureusement le flacon avant utilisation.
B-Appuyer fortement et tourner vers la droite la partie colorée du bouchon jusqu'à ce qu'il soit verrouillé.
C-Ouvrir le rabat.
D-Insérer la seringue sur le flacon en position verticale.
E-Retourner le flacon et prélever le volume prescrit de médicament vétérinaire, avec le flacon maintenu tête en bas.
F-Une fois rempli, retourner le flacon. Retirer la seringue en position verticale.
G-Fermer le rabat.
H-Tourner à gauche et tirer vers le haut la partie colorée du bouchon.
Administrer le médicament vétérinaire en le versant sur une partie de la nourriture ou en l'administrant directement dans la bouche de l'animal. Porter des gants imperméables lors de la manipulation du médicament vétérinaire et/ou de l'administration du médicament vétérinaire dans la bouche de l'animal.
En cas d'administration sur la nourriture, attendre que l'animal ait complètement consommé l'aliment médicamenté, puis donner le reste de la nourriture.

3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Le risque de survenue d'effets indésirables est plus important à des doses et sur des durées de traitement supérieures à celles recommandées. Si des signes neurologiques apparaissent, le traitement doit être interrompu et l'animal doit être traité symptomatiquement.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QP51AA01
4.2 Propriétés pharmacodynamiques
Une fois que le métronidazole a pénétré la bactérie, la molécule est réduite par la bactérie sensible (anaérobie). Les métabolites créés ont un effet toxique sur la bactérie en se liant à l'ADN bactérien. En général, le métronidazole a une action bactéricide sur les bactéries sensibles à des concentrations égales ou légèrement supérieures à la concentration minimale inhibitrice (CMI).
Des concentrations minimales inhibitrices (CMI) ont été déterminées pour le métronidazole dans des isolats européens de bactéries cibles, isolés en 2016 de chiens atteints d'une maladie gastro-intestinale.
Espèces | CMI (µg/mL) | CMI 50 (µg/mL) | CMI 90 (µg/mL) |
Clostridium spp. (C.difficile & C.perfringens) | 0,5 - 2 | 1 | 1 |
Les CMI des pathogènes collectés ont montré des profils de distribution mono-modale avec une bonne sensibilité au métronidazole. Les valeurs critiques cliniques* pour le métronidazole sont établies pour les anaérobies : sensible : ≤ 8 μg/mL ; intermédiaire : 16 µg/mL ; résistant : ≥ 32 μg/mL.
D'après ces valeurs critiques, aucune souche clinique résistante de Clostridium spp. pathogène n’a été observée.
*(CLSI, 2017. Performance Standards for Antimicrobial Susceptibility Testing -Twenty-Seventh Edition M100. Clinical and Laboratory Standards Institute (CLSI), Wayne, PA 19087-1898 USA)
Cliniquement, le métronidazole n'a aucun effet significatif sur les bactéries anaérobies facultatives, les bactéries aérobies strictes et les bactéries microaérophiles.
Le métronidazole est également actif sur les protozoaires. Chez Giardia spp. en particulier, le métronidazole cible principalement les trophozoïtes (réplication active du parasite) entraînant leur mort et par conséquent conduisant à une diminution considérable de l'excrétion de kystes.
4.3 Propriétés pharmacocinétiques
Après l’administration de la dose la plus élevée (50 mg/jour/kg de poids corporel), la biodisponibilité absolue est de 98 % chez le chien à jeun. La concentration maximale moyenne (Cmax) est de 62,4 μg/mL +/- 9,7 (moyenne +/- SD) dans le plasma et survient entre 0,25 et 4 heures après l'administration (Tmax). Il a été montré que la nourriture diminue la biodisponibilité orale qui reste élevée chez les chiens nourris avec un F (biodisponibilité) relatif de 81 % (avec F à jeun = 100 %). Le métronidazole pénètre dans les tissus et les fluides corporels, tels que la salive, le lait, les sécrétions vaginales et le sperme. Le métronidazole est métabolisé dans le foie par oxydation de la chaîne latérale et synthèse du glucuronide. Les deux métabolites et le médicament inchangé sont éliminés dans l'urine (principalement) et les fèces. La demi-vie d'élimination est entre 3 et 5 heures.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
En l'absence d'études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d'autres médicaments vétérinaires.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
Durée de conservation après première ouverture du conditionnement primaire:
- flacon de 30 mL : 3 mois.
- flacon de 100 mL : 6 mois.
5.3 Précautions particulières de conservation
A conserver en dessous de 30°C.
5.4 Nature et composition du conditionnement primaire
Flacon blanc opaque polyéthylène téréphtalate fermé avec un bouchon distributeur en plastique.
- conditionnement avec bouchon à pression :
- Présentation de 30 mL : flacon blanc opaque en polyéthylène téréphtalate (PET) équipé d'un bouchon de prélèvement en polypropylène (PP) avec bouchon en silicone et d'une seringue de 3 mL en polypropylène (PP);
- Présentation de 100 mL : flacon blanc opaque en polyéthylène téréphtalate (PET) équipé d'un bouchon de prélèvement en polypropylène (PP) avec bouchon en silicone et d'une seringue en polypropylène (PP) de 3 mL;
- conditionnement avec bouchon à vis :
- Présentation de 30 mL : flacon blanc opaque en polyéthylène téréphtalate (PET) équipé d'un bouchon à vis de prélèvement en polyéthylène (PE) avec joint PE et d'une seringue orale en polypropylène (PP) de 3 mL;
- Présentation de 100 mL : flacon blanc opaque en polyéthylène téréphtalate (PET) équipé d'un bouchon à vis de prélèvement en polyéthylène (PE) avec joint en PE et d'une seringue orale en polypropylène (PP) de 3 mL.
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l'élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
VIRBAC
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/3092401 7/2018
Boîte de 1 flacon de 30 mL et de 1 seringue graduée de 3 mL (bouchon à pression)
Boîte de 1 flacon de 100 mL et de 1 seringue graduée de 3 mL (bouchon à pression)
Boîte de 1 flacon de 30 mL et de 1 seringue graduée de 3 mL (bouchon à vis)
Boîte de 1 flacon de 100 mL et de 1 seringue graduée de 3 mL (bouchon à vis)
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
08/03/2018
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
23/01/2026
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l'Union sur les médicaments (https://medicines.health.europa.eu/veterinary).