KABERGOVET 50 MICROGRAMMES/ML SOLUTION BUVABLE POUR CHIENS ET CHATS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque mL contient : |
|
|
|
Substance active : |
|
Cabergoline ……………………………………. | 50,0 µg |
Excipient :
Composition qualitative en excipients et autres composants |
Triglycérides à chaîne moyenne |
Solution huileuse visqueuse, jaune pâle.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chiens, chats.
3.2 Indications d'utilisation pour chaque espèce cible
Traitement des pseudogestations chez les chiennes.
Suppression de la lactation chez les chiennes et les chattes.
3.3 Contre-indications
Ne pas utiliser chez les femelles gestantes, car le médicament vétérinaire peut provoquer un avortement.
Ne pas utiliser avec des antagonistes de la dopamine.
La cabergoline peut induire une hypotension artérielle transitoire chez les animaux traités. Ne pas l’utiliser chez les animaux sous traitement antihypertenseur concomitant. Ne pas utiliser immédiatement après une intervention chirurgicale lorsque l’animal est toujours sous l’effet des agents anesthésiques.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
3.4 Mises en garde particulières
Des traitements de soutien supplémentaires sont une restriction de la consommation d’eau et de glucides ainsi qu’une augmentation de l’activité physique.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Le médicament vétérinaire doit être administré avec prudence chez les animaux atteints d’insuffisance hépatique.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Se laver les mains après utilisation. Éviter tout contact avec la peau et les yeux. Laver immédiatement toute éclaboussure.
Les femmes en âge de procréer et les femmes qui allaitent ne doivent pas manipuler ce médicament vétérinaire ou doivent porter des gants imperméables lors de l’administration du médicament vétérinaire.
Les personnes présentant une hypersensibilité connue à la cabergoline ou à l’excipient doivent éviter tout contact avec le médicament vétérinaire.
Ne pas laisser de seringues remplies sans surveillance à portée de vue et en présence d’enfants. En cas d’ingestion accidentelle, en particulier chez un enfant, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Chiens, chats :
Rare (1 à 10 animaux / 10 000 animaux traités) : | Somnolence1, anorexie1 Vomissement1,2 |
Très rare (< 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Hypotension3 Réactions allergiques (œdème, urticaire, prurit) Dermatite allergique Symptômes neurologiques (somnolence, tremblements musculaires, ataxie, convulsions) Hyperactivité |
1 de nature modérée et transitoire.
2 Généralement, le vomissement survient uniquement après la première administration. Dans ce cas, le traitement ne doit pas être arrêté, car il est peu probable que le vomissement se reproduise après les administrations suivantes.
3 transitoire.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation :
La cabergoline peut provoquer un avortement au cours des derniers stades de la gestation et ne doit pas être utilisé chez les femelles gestantes. Un diagnostic différentiel entre une gestation et une pseudo-gestation doit être correctement établi.
Le médicament vétérinaire est indiqué pour la suppression de la lactation : l’inhibition de la sécrétion de la prolactine par la cabergoline entraîne un arrêt rapide de la lactation et une réduction de la taille des glandes mammaires. Le médicament vétérinaire ne doit pas être utilisé chez les femelles en lactation à moins qu’un tarissement ne soit nécessaire.
3.8 Interactions médicamenteuses et autres formes d'interactions
Étant donné que la cabergoline exerce son effet thérapeutique par stimulation directe des récepteurs de la dopamine, le médicament vétérinaire ne doit pas être administré en même temps que des médicaments dotés d’une activité antagoniste de la dopamine (tels que les phénothiazines, les butyrophénones et le métoclopramide), car ceux-ci pourraient réduire les effets inhibiteurs de la prolactine.
Étant donné que la cabergoline peut induire une hypotension artérielle transitoire, le médicament vétérinaire ne doit pas être utilisé chez des animaux sous traitement antihypertenseur concomitant.
3.9 Voies d'administration et posologie
Voie orale, soit directement dans la gueule, soit mélangé à de la nourriture.
La posologie est de 0,1 mL/kg de poids corporel (équivalent à 5 microgrammes/kg de poids corporel de cabergoline), une fois par jour pendant 4 à 6 jours consécutifs selon la sévérité de l’état clinique.
Si les signes ne disparaissent pas après un seul cycle de traitement ou s’ils réapparaissent après la fin du traitement, le cycle de traitement pourra être répété.
Afin de garantir une posologie appropriée, le poids corporel doit être déterminé aussi précisément que possible avant l'administration.
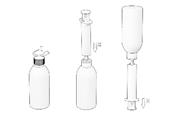
Comment extraire le volume recommandé du flacon ?
1. Dévisser le bouchon,
2. Connecter la seringue fournie sur le flacon,
3. Retourner le flacon vers le bas pour extraire le liquide.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Les données expérimentales indiquent qu’un surdosage unique de cabergoline pourrait entraîner une augmentation du risque de vomissement post-traitement et éventuellement une amplification de l’hypotension post-traitement.
Des mesures générales de soutien doivent être instaurées pour permettre l’élimination du médicament non absorbé et maintenir la pression artérielle, si nécessaire. L’administration parentérale de médicaments antagonistes de la dopamine tels que du métoclopramide doit être envisagée comme antidote.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QG02CB03.
4.2 Propriétés pharmacodynamiques
La cabergoline est un dérivé de l’ergoline. Elle présente une activité dopaminergique entraînant une inhibition de la sécrétion de prolactine par la glande pituitaire antérieure. Le mécanisme d’action de la cabergoline a été étudié chez des modèles in vitro et in vivo.
Les observations les plus importantes sont indiquées ci-dessous :
- Le cabergoline inhibe la sécrétion de la prolactine par la glande pituitaire et inhibe tous les processus dépendants de la prolactine tels que la lactation. L’inhibition maximale est atteinte après 4 à 8 heures et dure plusieurs jours selon la dose administrée ;
- La cabergoline n’a aucun autre effet sur le système endocrinien en dehors de l’inhibition de la sécrétion de prolactine ;
- La cabergoline est un agoniste de la dopamine au sein du système nerveux central par interaction sélective avec les récepteurs dopaminergiques D2 ;
- La cabergoline présente une affinité pour les récepteurs noradrénergiques. Cependant, elle ne cause aucune interférence avec les métabolismes de la noradrénaline et de la sérotonine.
La cabergoline est un émétique comme les autres dérivés de l’ergoline (activité comparable à celle de la bromocriptine et de la pergolide).
4.3 Propriétés pharmacocinétiques
Il n’existe aucune donnée pharmacocinétique disponible pour les schémas thérapeutiques recommandés dans le cas des chiens et des chats.
Des études pharmacocinétiques ont été menées chez des chiens avec une dose quotidienne de 80 µg/kg de poids corporel (16 fois la dose recommandée). Les chiens ont été traités pendant 30 jours. Les évaluations pharmacocinétiques ont été réalisées les jours 1 et 28.
Absorption
- Tmax = 1 heure le jour 1 et 0,5-2 heures le jour 28 ;
- La Cmax ètait comprise entre 1140 et 3155 pg/mL (moyenne de 2147 pg/mL) le jour 1, et entre 455 et 4217 pg/mL (moyenne de 2336 pg/mL) le jour 28 ;
- L’air sous la courbe (0-24 h) est située entre 3896 et 10216 pg.h/mL (moyenne de 7056 pg.h/mL) le jour 1, et entre 3231 et 19043 pg.h/mL le jour 28 (moyenne de 11137 pg.h/mL).
Élimination
- Demi-vie plasmatique terminale chez les chiens le jour 1 ~ 19 heures ; le jour 28 ~ 10 heures.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
Le médicament vétérinaire ne doit pas être mélangé à d’autres solutions aqueuses (p. ex. du lait).
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 30 mois.
Durée de conservation après première ouverture du conditionnement primaire : 28 jours.
5.3 Précautions particulières de conservation
Conserver le flacon dans l’emballage extérieur de façon à le protéger de la lumière.
5.4 Nature et composition du conditionnement primaire
Flacon en PET ambré d’une capacité de 15 mL (contenu de 7 ou 15 mL) fermé par un capuchon vissable en PEHD et d’un opercule de sécurité en PEBD, fourni avec une seringue en PP de 3 mL pour administration orale avec piston en PEHD.
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
VET-AGRO MULTI-TRADE COMPANY SP. Z O.O.
UL. GLINIANA 32
20-616 LUBLIN
POLOGNE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/6847286 3/2020
Boîte de 1 flacon de 7 mL et 1 seringue pour administration orale
Boîte de 1 flacon de 15 mL et 1 seringue pour administration orale
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
09/12/2020
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
30/10/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).