METOMOTYL 5 COMPRIME A CROQUER POUR CHIENS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé contient : |
|
|
|
Substance active : |
|
Métoclopramide ………………………………………………... | 4,46 mg |
(sous forme de chlorhydrate monohydraté) |
|
(Équivalant à 5,0 mg de chlorhydrate de métoclopramide) |
|
|
|
Excipients : |
|
Composition qualitative en excipients et autres composants |
Levure (déshydratée) |
Arôme poulet |
Lactose anhydre |
Croscarmellose sodique |
Stéarate de magnésium |
Comprimé de 6 mm, brun clair tacheté de brun, rond et convexe, avec une barre de sécabilité en forme de croix sur une face.
Les comprimés peuvent être divisés en 2 ou 4 parties égales.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chiens.
3.2 Indications d'utilisation pour chaque espèce cible
Traitement symptomatique des vomissements fréquents, de la dilatation gastrique, de la gastrite chronique, du reflux duodéno-gastrique et de la diarrhée associée à une réduction de la motilité gastro-intestinale.
3.3 Contre-indications
Ne pas utiliser en cas d’hémorragie, de perforation ou d’occlusion gastro-intestinales.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
3.4 Mises en garde particulières
Ne pas utiliser chez les chiens pesant moins de 5 kg.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Éviter d’administrer le médicament chez des animaux présentant des troubles convulsifs, par exemple une épilepsie, ou un traumatisme crânien.
Le métoclopramide pouvant entraîner une augmentation des taux de prolactine, utiliser avec précaution chez des chiennes en pseudo-gestation.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Ce médicament vétérinaire peut provoquer des effets neurologiques en cas d’ingestion accidentelle, en particulier chez les enfants.
Les enfants ne doivent pas rentrer en contact avec le médicament vétérinaire. Les morceaux de comprimés inutilisés doivent être replacés dans l’alvéole ouverte de la plaquette qui doit être rangée dans la boîte. Ils doivent être soigneusement conservés hors de la portée des enfants et doivent toujours être utilisés lors de l’administration suivante.
En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Chiens :
Très rare (< 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Somnolence Diarrhées Signes neurologiques a (agitation, ataxie, posture et/ou mouvements anormaux, prostration, tremblements et agressivité, vocalisation) |
a Les effets observés sont transitoires et disparaissent à l’arrêt du traitement.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation :
L’innocuité du médicament vétérinaire n’a pas été établie en cas de gestation et de lactation. L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
3.8 Interactions médicamenteuses et autres formes d'interactions
En cas de gastrite, éviter la co-administration de substances anticholinergiques (atropine) car elles pourraient neutraliser les effets du métoclopramide sur la motilité gastro-intestinale.
En cas de diarrhée simultanée, l’utilisation de substances anticholinergiques n’est pas contre-indiquée.
L’utilisation concomitante de métoclopramide et de neuroleptiques dérivés de la phénothiazine (acépromazine) et des butyrophénones augmente le risque d’effets neurologiques (voir rubrique 3.6.
Le métoclopramide peut potentialiser l’action des dépresseurs du système nerveux central. En cas d’administration concomitante, il est conseillé d’utiliser la dose de métoclopramide la plus faible possible pour éviter une sédation excessive.
3.9 Voies d'administration et posologie
Voie orale.
La dose recommandée est de 0,22 mg de métoclopramide (soit 0,25 mg de chlorhydrate de métoclopramide) par kg de poids corporel, 4 fois par jour.
Le tableau ci-dessous fournit des indications sur la quantité de médicament vétérinaire à administrer :
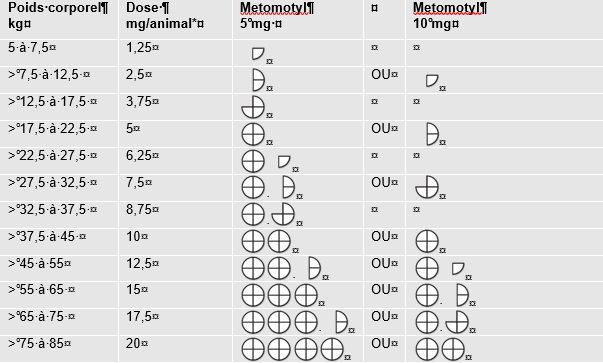
![]()
* dose en mg de chlorhydrate de métoclopramide par animal et par administration.
Les comprimés peuvent être divisés en 2 ou 4 parties égales pour obtenir l’exacte posologie nécessaire. Placez le comprimé sur une surface plate, avec la face portant la barre de sécabilité tournée vers le haut et la face convexe (arrondie) tournée vers le plan de travail.
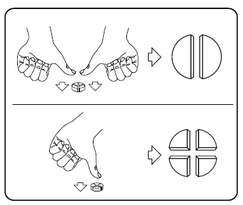
Pour obtenir 2 parties égales : appuyez avec vos pouces des deux côtés du comprimé.
Pour obtenir 4 parties égales : appuyez avec votre pouce au centre du comprimé.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
En cas surdosage, aucun effet indésirable autre que ceux mentionnés dans la rubrique 3.6 n’a été identifié.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QA03FA01.
4.2 Propriétés pharmacodynamiques
L’action anti-émétique du métoclopramide est principalement due à son activité antagoniste au niveau des récepteurs D2 dans le système nerveux central, empêchant les nausées et vomissements déclenchés par la plupart des stimuli.
L’effet prokinétique sur le transit gastro-duodénal (augmentation de l’intensité et du rythme des contractions gastriques et ouverture du pylore) est dû à son activité muscarinique, son activité antagoniste sur les récepteurs D2 et son activité agoniste sur les récepteurs 5-HT4 au niveau gastro-intestinal.
4.3 Propriétés pharmacocinétiques
Le métoclopramide est rapidement et totalement absorbé après administration orale.
Le métoclopramide est rapidement distribué dans la plupart des tissus et fluides corporels, et il traverse la barrière hémato-encéphalique.
Le métoclopramide est métabolisé par le foie. L’élimination du métoclopramide se fait essentiellement par voie urinaire.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
Sans objet.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
Durée de conservation des comprimés divisés : 3 jours.
5.3 Précautions particulières de conservation
Tout morceau de comprimé inutilisé doit être replacé dans l’alvéole ouverte de la plaquette qui doit être rangée dans la boîte.
5.4 Nature et composition du conditionnement primaire
Plaquette OPA/ALU/PVC/ALU.
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
DECHRA REGULATORY B.V.
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/7785449 4/2021
Boîte de 1 plaquette de 10 comprimés
Boîte de 10 plaquettes de 10 comprimés
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
24/06/2021
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
14/10/2025
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).