METROBACTIN 500 MG COMPRIMES POUR CHIENS ET CHATS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé contient : |
|
|
|
Substance active : |
|
Métronidazole ……………………………………… | 500 mg |
|
|
Excipients : |
|
Composition qualitative en excipients et autres composants |
Cellulose microcristalline |
Carboxyméthylamidon sodique de type A |
Hydroxypropylcellulose |
Levure de bière |
Arôme poulet |
Stéarate de magnésium |
Comprimé brun clair tacheté de brun, rond et convexe, aromatisé, avec une barre de sécabilité en croix sur une face.
Les comprimés peuvent être divisés en 2 ou 4 parties égales.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chiens, chats.
3.2 Indications d'utilisation pour chaque espèce cible
Traitement des infections gastro-intestinales dues à Giardia spp. et Clostridium spp. (c'est-à-dire C. perfringens ou C. difficile).
Traitement des infections de l’appareil urogénital, de la cavité buccale, de la gorge et de la peau due aux bactéries anaérobies strictes (par exemple, Clostridium spp.).
3.3 Contre-indications
Ne pas utiliser en cas de de troubles hépatiques.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
3.4 Mises en garde particulières
Aucune.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
En raison de la probable variabilité (temporelle et géographique) de la survenue de résistances bactériennes au métronidazole, un échantillonnage bactériologique et un test de sensibilité sont recommandés.
Dans la mesure du possible, le médicament vétérinaire devra être utilisé uniquement sur la base d’un test de sensibilité.
Les politiques officielles, nationales et régionales, en matière d’utilisation des antibiotiques doivent être prises en compte lorsque le médicament vétérinaire est utilisé. Les comprimés sont aromatisés. Conserver les comprimés hors de portée des animaux pour éviter toute ingestion accidentelle. En particulier à la suite d’un traitement prolongé par le métronidazole des signes neurologiques peuvent apparaître.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Le métronidazole peut provoquer des réactions d’hypersensibilité. Les personnes présentant une l’hypersensibilité connue au métronidazole doivent éviter tout contact avec le médicament vétérinaire.
Le métronidazole présente des propriétés mutagènes et génotoxiques confirmées chez les animaux de laboratoire ainsi que chez l’être humain. Le métronidazole est un cancérogène confirmé chez les animaux de laboratoire et pourrait avoir des effets cancérigènes chez l’être humain. Toutefois, les données concernant la cancérogénicité du métronidazole chez l’être humain sont insuffisantes.
Le métronidazole peut être nocif pour le fœtus.
Eviter l’ingestion accidentelle et tout contact avec la peau ou les muqueuses, dont le contact main-bouche.
Pour cela, porter des gants imperméables lors de la manipulation du médicament vétérinaire et/ou au moment de l’administration dans la gueule de l’animal.
Ne pas laisser les animaux lécher des personnes immédiatement après la prise du médicament.
En cas de contact cutané, laver soigneusement la zone concernée.
Afin d’éviter toute ingestion accidentelle, en particulier par un enfant, les fractions de comprimés non utilisées doivent être replacées dans l’alvéole ouverte de la plaquette et remises dans la boîte, gardée hors de vue et de portée des enfants. La fraction de comprimée restante doit être utilisée lors de l’administration suivante.
En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette. Se laver soigneusement les mains après utilisation.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Chiens, chats :
Très rare ( < 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Signes neurologiques Vomissements Hépatite toxique Neutropénie |
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation :
Les études chez les animaux de laboratoire ont donné des résultats contradictoires concernant les effets tératogènes/embryotoxiques du métronidazole. Par conséquent, l’utilisation de ce médicament vétérinaire n’est pas recommandée durant la gestation.
Lactation :
Le métronidazole est excrété dans le lait et son utilisation durant la lactation n’est donc pas recommandée.
3.8 Interactions médicamenteuses et autres formes d'interactions
Le métronidazole peut avoir un effet inhibiteur sur la dégradation de certains autres médicaments dans le foie, tels que la phénytoïne, la ciclosporine et la warfarine.
La cimétidine peut réduire le métabolisme hépatique du métronidazole, aboutissant à une augmentation des concentrations sériques du métronidazole.
Le phénobarbital peut augmenter le métabolisme hépatique du métronidazole, aboutissant à une réduction des concentrations sériques du métronidazole.
3.9 Voies d'administration et posologie
Voie orale.
La dose recommandée est de 50 mg de métronidazole par kg de poids corporel par jour, pendant 5 à 7 jours. La dose quotidienne peut être répartie à égalité sur deux prises quotidiennes (c'est-à-dire 25 mg de métronidazole par kg de poids corporel deux fois par jour).
Afin de garantir l’administration d’une posologie appropriée, le poids corporel de l'animal doit être déterminé aussi précisément que possible.
Les comprimés peuvent être divisés en 2 ou 4 parties égales pour obtenir l’exacte posologie nécessaire. Placez le comprimé sur une surface plate, avec la face portant la barre de sécabilité tournée vers le haut et la face convexe (arrondie) tournée vers le plan de travail.
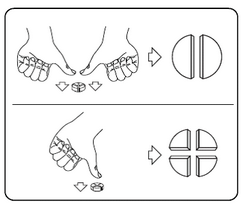
Moitiés : appuyez avec vos pouces des deux côtés du comprimé.
Quarts : appuyez avec votre pouce au centre du comprimé.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Le risque de survenue d’effets indésirables est plus important en cas de traitement à des doses et sur des durées supérieures à celles recommandées. Si des signes neurologiques apparaissent, le traitement doit être interrompu et une prise en charge symptomatique doit être instaurée.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QJ01XD01.
4.2 Propriétés pharmacodynamiques
Une fois que le métronidazole a pénétré la bactérie, la molécule est réduite par la bactérie (anaérobie) sensible. Les métabolites ainsi créés exercent un effet toxique sur la bactérie en se liant à l’ADN bactérien. En général, le métronidazole a une action bactéricide sur les bactéries sensibles à des concentrations égales ou légèrement supérieures à la concentration minimale inhibitrice (CMI).
D’un point de vue clinique, le métronidazole n’a pas d’effet significatif sur les bactéries anaérobies facultatives, aérobies strictes et microaérophiles.
4.3 Propriétés pharmacocinétiques
Le métronidazole est immédiatement et bien absorbé après administration orale. Au bout d’une heure, une concentration plasmatique de 10 µg/ml a été atteinte lors de l’administration d’une dose unique de 50 mg. La biodisponibilité du métronidazole est proche de 100 % et sa demi-vie plasmatique est d’environ 8 à 10 heures. Le métronidazole a une bonne pénétration dans les tissus et les fluides corporels tels que la salive, le lait, les sécrétions vaginales et le sperme. Le métronidazole est métabolisé principalement dans le foie. Dans les 24 heures suivant l’administration orale, 35 % à 65 % de la dose administrée sont excrétés (sous forme de métronidazole et de ses métabolites) dans l’urine.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
Sans objet.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
Durée de conservation des fractions de comprimé : 3 jours.
5.3 Précautions particulières de conservation
Ce médicament vétérinaire ne nécessite pas de conditions particulières de conservation.
5.4 Nature et composition du conditionnement primaire
Plaquette PVDC/PE/PVC - aluminium
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
DECHRA REGULATORY B.V.
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/2612803 2/2015
Boîte en carton de 1 plaquette de 10 comprimés
Boîte en carton de 2 plaquettes thermoformées de 10 comprimés
Boîte en carton de 3 plaquettes thermoformées de 10 comprimés
Boîte en carton de 4 plaquettes thermoformées de 10 comprimés
Boîte en carton de 5 plaquettes thermoformées de 10 comprimés
Boîte en carton de 6 plaquettes thermoformées de 10 comprimés
Boîte en carton de 7 plaquettes thermoformées de 10 comprimés
Boîte en carton de 8 plaquettes thermoformées de 10 comprimés
Boîte en carton de 9 plaquettes thermoformées de 10 comprimés
Boîte en carton de 10 plaquettes thermoformées de 10 comprimés
Boîte en carton de 25 plaquettes thermoformées de 10 comprimés
Boîte en carton de 50 plaquettes thermoformées de 10 comprimés
Boîte en carton contenant 10 boîtes en carton de 1 plaquette de 10 comprimés
Boîte en carton contenant 10 boîtes en carton de 10 plaquettes de 10 comprimés
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
15/10/2015
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
08/01/2025
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).