METRONIDAVET COMPRIMES 500 MG POUR CHIENS ET CHATS
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé contient : |
|
|
|
Substance active: |
|
Métronidazole …………………………………………….. | 500 mg |
Excipients :
Composition qualitative en excipients et autres composants |
Cellulose, microcristalline |
Carboxyméthylamidon sodique type A |
Hydroxypropylcellulose |
Silice colloïdale hydratée |
Stéarate de magnésium |
Extrait de levure |
Oxyde de fer brun (E172) |
Comprimé aromatisé rond et convexe brun clair avec des taches brunes présentant une ligne de sécabilité en forme de croix sur un côté. Les comprimés peuvent être divisés en deux ou en quatre parties égales.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chiens et chats.
3.2 Indications d'utilisation pour chaque espèce cible
Traitement des infections gastro-intestinales dues à Giardia spp. et Clostridia spp.(i.e C. perfringens ou C. difficile).
Traitement des infections de l’appareil urogénital, de la cavité buccale, de la gorge et de la peau dues à des bactéries anaérobies strictes (par exemple, Clostridia spp.) sensibles au métronidazole.
3.3 Contre-indications
Ne pas utiliser chez les animaux souffrant de troubles hépatiques.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
3.4 Mises en garde particulières
Aucune.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
En raison de la probable variabilité (temporelle, géographique) de la survenue de résistances bactériennes au métronidazole, un échantillonnage bactériologique et des tests de sensibilité sont recommandés.
Dans la mesure du possible, le médicament vétérinaire ne doit être utilisé que sur la base d’un test de sensibilité.
Les politiques officielles, nationales et régionales en matière d'utilisation des agents antimicrobiens doivent être prises en compte lors de l’utilisation du médicament vétérinaire. Des signes neurologiques peuvent apparaître, en particulier à la suite d’un traitement prolongé avec le métronidazole.
Les comprimés étant aromatisés, les conserver hors de la portée des animaux afin d’éviter toute ingestion accidentelle.
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Le métronidazole présente des propriétés mutagènes et génotoxiques avérées chez les animaux de laboratoire ainsi que chez l’être humain. Le métronidazole est un cancérigène avéré chez les animaux de laboratoire et est susceptible d’avoir des effets cancérigènes chez l’être humain. Cependant, les preuves concernant la cancérogénicité du métronidazole chez l’être humain sont insuffisantes.
Le métronidazole peut être nocif pour le fœtus. Les femmes enceintes doivent être prudentes lorsqu’elles manipulent ce médicament vétérinaire. Un équipement de protection individuelle consistant en des gants imperméables doivent être portés lors de l’administration du médicament vétérinaire.
Afin d’éviter toute ingestion accidentelle, en particulier par un enfant, les fractions de comprimés inutilisés doivent être replacées dans l’alvéole ouverte de la plaquette, qui doit être remise dans l’emballage extérieur et conservée en lieu sûr hors de la vue et de la portée des enfants. En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Le métronidazole peut provoquer des réactions d’hypersensibilité. Les personnes présentant une hypersensibilité connue au métronidazole, doivent éviter tout contact avec le médicament vétérinaire.
Se laver soigneusement les mains après avoir manipulé les comprimés.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Chiens et chats
Très rare (< 1 animal / 10 000 animaux traités, y compris les cas isolés): | Symptômes neurologiques |
Fréquence indéterminée (ne peut être estimé à partir des données disponibles) | Vomissements Hépatotoxicité Neutropénie |
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation :
Des études chez des animaux de laboratoire ont montré des résultats incohérents concernant les effets tératogènes/embryotoxiques du métronidazole. Par conséquent, l’utilisation de ce médicament vétérinaire n’est pas recommandée durant la gestation.
Lactation :
Le métronidazole est excrété dans le lait et son utilisation pendant la lactation n’est donc pas recommandée.
3.8 Interactions médicamenteuses et autres formes d'interactions
Le métronidazole pourrait avoir un effet inhibiteur sur la dégradation d’autres médicaments dans le foie, comme la phénytoïne, la cyclosporine et la warfarine.
La cimétidine pourrait diminuer le métabolisme hépatique du métronidazole et donc augmenter sa concentration sérique.
Le phénobarbital pourrait augmenter le métabolisme hépatique du métronidazole et donc diminuer sa concentration sérique.
3.9 Voies d'administration et posologie
Voie orale.
La dose recommandée est de 50 mg de métronidazole par kg de poids corporel par jour, pendant 5 à 7 jours. La dose journalière doit être de préférence divisée en deux doses égales pour une administration deux fois par jour (i.e. 25 mg/kg de poids corporel deux fois par jour).
Afin de garantir une posologie appropriée, le poids corporel doit être déterminé aussi précisément que possible.
| Nombre de comprimés de 500 mg | |
Poids corporel (kg) | Deux fois par jour | Une fois par jour |
2,5 kg | - | ¼ |
5 kg | ¼ | ½ |
10 kg | ½ | 1 |
15 kg | ¾ | 1½ |
20 kg | 1 | 2 |
25 kg | 1¼ | 2½ |
30 kg | 1½ | 3 |
35 kg | 1¾ | 3½ |
40 kg | 2 | 4 |
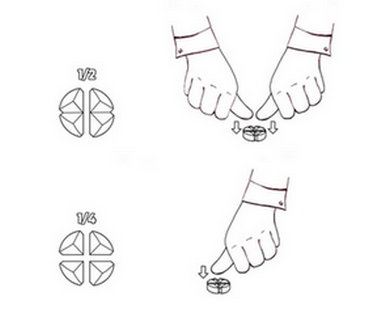
Les comprimés peuvent être divisés en 2 ou 4 parties égales pour garantir un dosage correct.
Placez le comprimé sur une surface plane, avec la face pointillée vers le haut et la face convexe (arrondie) vers la surface.
Moitiés : appuyez avec vos pouces sur les deux côtés du comprimé.
Quarts : appuyez avec votre pouce au centre du comprimé.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Le risque de survenue d’effets indésirables est plus important en cas de traitement à des doses et sur des durées supérieures à celles recommandées. Si des signes neurologiques apparaissent, le traitement doit être interrompu et un traitement symptomatique doit être instauré.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QP51AA01.
4.2 Propriétés pharmacodynamiques
Une fois que le métronidazole a pénétré la bactérie, la molécule est réduite par les bactéries sensibles (anaérobies). Les métabolites créés ont un effet toxique sur les bactéries en se liant à l’ADN bactérien. En général, le métronidazole est bactéricide pour les bactéries sensibles à des concentrations égales ou légèrement supérieures à la concentration minimale inhibitrice (CMI).
4.3 Propriétés pharmacocinétiques
Le métronidazole est immédiatement et bien absorbé après administration par voie orale. Au bout d’1 heure, une concentration plasmatique de 10 µg/mL a été atteinte avec une dose unique de 50 mg. La biodisponibilité du métronidazole est proche de 100 %, et la demi-vie terminale dans le plasma est d’environ 8 à 10 heures. Le métronidazole pénètre bien dans les tissus et les fluides corporels tels que la salive, le lait, les sécrétions vaginales et le sperme. Le métronidazole est principalement métabolisé au niveau du foie. Dans les 24 heures suivant l’administration orale, 35 à 65 % de la dose administrée (métronidazole et ses métabolites) sont excrétés dans les urines.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
Sans objet.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 30 mois.
Durée de conservation des fractions de comprimés : 3 jours.
5.3 Précautions particulières de conservation
Ce médicament vétérinaire ne nécessite aucune précaution particulière de conservation. Replacer tout comprimé divisé dans la plaquette.
5.4 Nature et composition du conditionnement primaire
Plaquette Aluminium OPA-Aluminium-PVC.
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
VET-AGRO MULTI-TRADE COMPANY SP. Z O.O.
UL. GLINIANA 32
20-616 LUBLIN
POLOGNE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/9933654 7/2021
Boîte en carton de 2 plaquettes de 10 comprimés quadrisécables
Boîte en carton de 10 plaquettes de 10 comprimés quadrisécables
Boîte en carton de 25 plaquettes de 10 comprimés quadrisécables
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
05/03/2021
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
27/11/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).