PIMOCARD 5 MG COMPRIMES
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé contient : |
|
|
|
Substance active : |
|
Pimobendane .……………………………….. | 5 mg |
|
|
Excipients : |
|
Composition qualitative en excipients et autres composants |
Cellulose microcristalline |
Croscamellose sodique |
Stéarate de magnésium |
Arôme viande |
Comprimés ronds de couleur brun clair, marqués sur une face et lisses sur l'autre face.
Les comprimés peuvent être partagés en quatre parts égales.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chiens.
3.2 Indications d'utilisation pour chaque espèce cible
Traitement de l'insuffisance cardiaque congestive due à une insuffisance valvulaire (régurgitation mitrale et/ou tricuspidienne) ou à une cardiomyopathie dilatée.
3.3 Contre-indications
Ne pas utiliser en cas de cardiomyopathies hypertrophiques ou dans le cas d'états cliniques ou l'augmentation du débit cardiaque n'est pas possible pour des raisons fonctionnelles ou anatomiques (par exemple sténose aortique).
Voir également la rubrique « 3.7 - Utilisation en cas de gestation, de lactation ou de ponte ».
3.4 Mises en garde particulières
Le médicament vétérinaire doit être administré au moins une heure avant les repas, car l'absorption est réduite en cas d'ingestion simultanée de nourriture.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Le médicament vétérinaire est aromatisé. Afin d'éviter toute ingestion accidentelle, garder les comprimés hors de portée des chiens. Une étude in vitro sur des tissus de rat a démontré que le pimobendane augmentait la libération d'insuline glucose-dépendante des cellules bêta pancréatiques en fonction de la dose. Si le médicament vétérinaire est administré à des chiens diabétiques, les niveaux de glycémie doivent être surveillés attentivement. Comme le pimobendane est métabolisé dans le foie, il convient de prendre des précautions suffisantes lors de l'administration du médicament vétérinaire aux chiens atteints d'une insuffisance hépatique sévère.
La surveillance de la fonction et de la morphologie cardiaques est recommandée chez les animaux traités au pimobendane. Voir également la rubrique « 3.6 - Effets indésirables ».
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
En cas d'ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l'étiquette.
Se laver les mains après usage.
Pour le médecin : l'ingestion accidentelle, particulièrement chez les enfants, peut entraîner un épisode de tachycardie, d'hypotension orthostatique, une rougeur de la face et des maux de tête.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
3.6 Effets indésirables
Chiens :
Rare (1 à 10 animaux / 10 000 animaux traités) : | Augmentation de la fréquence cardiaque1,2, Augmentation de la régurgitation mitrale3 Vomissements2, Diarrhée4 Anorexie4, Léthargie4. |
Très rare (< 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Pétéchies sur les muqueuses5, Hémorragie sous-cutanée5. |
1 Modérée.
2 Ces effets sont liés à la dose et peuvent être évités par une réduction de la dose.
3 Une augmentation de la régurgitation mitrale a été observée durant un traitement chronique au pimobendane chez des chiens atteints d'insuffisance mitrale.
4 Passagère.
5 Une relation avec le pimobendane n'a pas été clairement établie ; les signes disparaissent à l'arrêt du traitement.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation et lactation :
Les études de laboratoire menées sur les rats et les lapins n'ont pas mis en évidence d'effets tératogènes ou fœtotoxiques. Ces études n'ont pas mis en évidence d'effets maternotoxiques et embryotoxiques à des dosages élevés, mais ont démontré que le pimobendane est excrété dans le lait. L’innocuité du médicament vétérinaire n'a pas été évaluée chez les chiennes gestantes ou allaitantes. L'utilisation ne doit se faire qu'après évaluation du rapport bénéfice/risque établi par le vétérinaire responsable.
3.8 Interactions médicamenteuses et autres formes d'interactions
Des études pharmacologiques n'ont pas détecté d'interaction entre l'ouabaïne, un glycoside cardiotonique, et le pimobendane. L'augmentation de la contractilité du cœur liée au pimobendane est diminuée en présence du vérapamil (inhibiteur calcique) et du propranolol (bêta-bloquant).
3.9 Voies d'administration et posologie
Voie orale.
Afin de garantir une posologie appropriée, le poids corporel doit être déterminé aussi précisément que possible.
Les comprimés doivent être administrés à un dosage de 0,2 mg à 0,6 mg de pimobendane par kg de poids corporel par jour. La dose journalière conseillée est de 0,5 mg de pimobendane par kg de poids corporel.
La dose doit être répartie en 2 administrations orales de 0,25 mg par kg, la moitié de la dose le matin et l'autre moitié environ 12 heures plus tard. La dose d'entretien doit être ajustée individuellement par le vétérinaire en fonction de la gravité de la maladie.
Chaque dose doit être administrée environ une heure avant le repas.
Ne pas dépasser la dose recommandée.
Le médicament vétérinaire peut être associé à un traitement diurétique, comme par exemple le furosémide.
Pour couper en quatre un comprimé à rainure double, le placer sur une surface plane avec la face marquée vers le haut et appliquer une pression au centre avec le pouce.
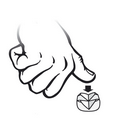
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
En cas de surdosage, un effet chronotrope positif et des vomissements peuvent survenir. Dans ce cas, il y a lieu de réduire le dosage et d'initier un traitement symptomatique approprié.
En cas d’exposition prolongée (chiens beagles en bonne santé recevant 3 à 5 fois la dose recommandée pendant 6 mois), un épaississement de la valve mitrale et une hypertrophie ventriculaire gauche ont été observés chez certains chiens.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Sans objet.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QC01CE90.
4.2 Propriétés pharmacodynamiques
Le pimobendane, un dérivé du benzimidazole pyridazinone, est une substance non sympathomimétique, inotrope non glycoside, dotée de puissantes propriétés vasodilatatrices.
Le pimobendane exerce ses effets stimulants du myocarde par un double mécanisme d'action : il augmente la sensibilité au calcium des myofilaments cardiaques et inhibe la phosphodiestérase de type III en provoquant ainsi un effet vasodilatateur.
Dans des cas d'insuffisance valvulaire, il a été prouvé que le médicament vétérinaire utilisé en association avec du furosémide améliorait la qualité de vie et prolongeait l'espérance de vie des chiens traités.
Dans un nombre limité de cas de cardiomyopathie dilatée, il a été prouvé que le médicament vétérinaire utilisé en association avec du furosémide, de l'énalapril et de la digoxine améliorait la qualité de vie et prolongeait l'espérance de vie des chiens traités.
4.3 Propriétés pharmacocinétiques
Absorption :
Après administration orale de ce médicament vétérinaire, la biodisponibilité absolue de la substance active est de 60 – 63 %. Cette biodisponibilité étant considérablement réduite quand le pimobendane est administré avec de la nourriture ou peu de temps après, il est recommandé de traiter les animaux environ 1 heure avant le repas.
Distribution :
Le volume de distribution est de 2,6 L/kg, ce qui indique que le pimobendane est distribué facilement dans les tissus. Le taux de liaison moyen aux protéines plasmatiques est de 93 %.
Métabolisme :
Le pimobendane est déméthylé par oxydation en son principal métabolite actif (UD-CG 212). Les autres métabolites sont les conjugués de phase II du UD-CG-212, essentiellement des glucuronides et des sulfates.
Elimination :
La demi-vie plasmatique du pimobendane est de 1,1 ± 0,7 heures.
Le principal métabolite actif est éliminé avec une demi-vie plasmatique de 1,5 ± 0,2 heures. Presque toute la dose est éliminée via les fèces.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
Sans objet.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 30 mois.
Durée de conservation des comprimés divisés après la première ouverture de la plaquette thermoformée : 3 jours.
5.3 Précautions particulières de conservation
A conserver à une température ne dépassant pas 30°C.
Remettre les comprimés divisés dans la plaquette thermoformée ouverte et les utiliser dans les 3 jours.
5.4 Nature et composition du conditionnement primaire
Plaquette thermoformée aluminium – PVC/PE/PVDC
Plaquette thermoformée aluminium – aluminium
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
EUROVET ANIMAL HEALTH B.V.
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/0881941 3/2013
Boîte de 2 plaquettes thermoformées aluminium – PVC/PE/PVDCde 10 comprimés quadrisécables
Boîte de 5 plaquettes thermoformées aluminium – PVC/PE/PVDC de 10 comprimés quadrisécables
Boîte de 10 plaquettes thermoformées aluminium – PVC/PE/PVDC de 10 comprimés quadrisécables
Boîte de 25 plaquettes thermoformées aluminium – PVC/PE/PVDC de 10 comprimés quadrisécables
Boîte de 4 plaquettes thermoformées aluminium – aluminium de 5 comprimés quadrisécables
Boîte de 10 plaquettes thermoformées aluminium – aluminium de 5 comprimés quadrisécables
Boîte de 20 plaquettes thermoformées aluminium – aluminium de 5 comprimés quadrisécables
Boîte de 50 plaquettes thermoformées aluminium – aluminium de 5 comprimés quadrisécables
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
22/03/2013
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
20/08/2025
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments (https://medicines.health.europa.eu/veterinary).