PRASEQUINE 1 MG COMPRIMES POUR CHEVAUX
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un comprimé contient : |
|
|
|
Substance(s) active(s) : |
|
Pergolide ………………………………………………… | 1,0 mg |
(équivalant à 1,31 mg de mésilate de pergolide) |
|
Composition qualitative des excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Lactose monohydraté | / |
Croscarmellose sodique | / |
Povidone | / |
Stéarate de magnésium | / |
Oxyde de fer jaune (E172) | / |
Comprimé beige rond et convexe, avec une double barre de sécabilité en forme de croix sur une face.
Les comprimés peuvent être divisés en deux ou quatre parts égales.
3. INFORMATIONS CLINIQUES
3.1 Espèces cibles
Chevaux (non producteur de denrées).
3.2 Indications d'utilisation pour chaque espèce cible
Traitement symptomatique des signes cliniques associés au Dysfonctionnement du Lobe Intermédiaire de l'Hypophyse ou Dysfonctionnement de la Pars Intermedia Pituitaire (Pituitary Pars Intermedia Dysfunction - PPID) ou syndrome de Cushing équin.
3.3 Contre-indications
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à d'autres dérivés de l'ergot de seigle, ou à l'un des excipients.
Ne pas utiliser chez les chevaux de moins de 2 ans.
3.4 Mises en garde particulières
Des tests endocriniens de laboratoire appropriés, ainsi qu'une évaluation des signes cliniques doivent être réalisés pour établir le diagnostic de PPID.
3.5 Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Comme la majorité des cas de PPID sont diagnostiqués chez des chevaux âgés, d'autres processus pathologiques sont fréquemment présents. Pour le suivi du traitement et la fréquence des tests, voir la rubrique « Voies d’administration et posologie ».
Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Ce médicament vétérinaire peut causer une irritation oculaire, une irritation olfactive ou des maux de tête après la division des comprimés. Éviter tout contact avec les yeux et l’inhalation lors de la manipulation des comprimés. Réduire au minimum le risque d’exposition lors de la division ou dissolution des comprimés : par exemple, ne pas broyer les comprimés.
En cas de contact avec la peau, laver à l’eau la partie exposée. En cas d’exposition oculaire au pergolide, rincer immédiatement l'œil atteint avec une grande quantité d’eau et demander conseil à un médecin. En cas d'irritation nasale, respirer de l’air frais et demander conseil à un médecin si des difficultés respiratoires apparaissent.
Ce médicament vétérinaire peut provoquer des réactions d’hypersensibilité (allergie). Les personnes présentant une hypersensibilité connue au pergolide ou à d’autres dérivés de l’ergot de seigle doivent éviter tout contact avec le médicament vétérinaire. Ce médicament vétérinaire peut provoquer des effets indésirables dus à la diminution des taux de prolactine, ce qui expose les femmes enceintes et qui allaitent à un risque particulier. Les femmes enceintes ou qui allaitent doivent éviter tout contact dermique ou tout contact main-bouche et porter des gants lors de l’administration du médicament vétérinaire.
Une ingestion accidentelle peut causer des vomissements, des vertiges, une léthargie ou une baisse de la tension artérielle, spécialement chez les enfants.
Pour éviter toute ingestion accidentelle, conservez soigneusement ce médicament hors de la vue et de la portée des enfants. Les parts de comprimés non utilisées doivent être replacées dans l'alvéole ouverte de la plaquette. Les plaquettes doivent être replacées dans leur emballage extérieur et conservées en lieu sûr. En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Ne pas manger, boire ou fumer lors de la manipulation de ce produit. Se laver les mains après utilisation.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
Sans objet.
3.6 Effets indésirables
Chevaux :
Rare (1 à 10 animaux / 10 000 animaux traités) : | Manque d'appétit, anorexie et léthargie transitoires, signes légers affectant le système nerveux central (par exemple légères dépression et ataxie), diarrhée et coliques |
Très rare (< 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Sudation |
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la rubrique ‘Coordonnées’ de la notice pour les coordonnées respectives.
3.7 Utilisation en cas de gestation, de lactation ou de ponte
Gestation :
L’innocuité de ce médicament vétérinaire n'a pas été établie chez les juments gestantes. Les études de laboratoire sur les souris et les lapins n'ont pas mis en évidence d'effets tératogènes. Une réduction de la fertilité a été observée chez les souris à une dose de 5,6 mg/kg/jour. L’utilisation ne doit se faire qu'après une évaluation du rapport bénéfice/risque établie par le vétérinaire.
Lactation :
L'utilisation du médicament vétérinaire n'est pas recommandée chez les juments en lactation, l’innocuité du médicament vétérinaire n'a pas été établie. Chez les souris, une réduction du poids corporel et des taux de survie de la descendance a été attribuée à l'inhibition pharmacologique de la sécrétion de prolactine, entraînant une chute de lactation.
3.8 Interactions médicamenteuses et autres formes d'interactions
Utiliser avec précaution lors de l'administration concomitante d'autres médicaments connus pour affecter la liaison aux protéines plasmatiques. Ne pas administrer en même temps que des antagonistes de la dopamine, tels que les neuroleptiques (phénothiazines, par exemple l'acépromazine), la dompéridone ou le métoclopramide, car ces molécules peuvent réduire l'efficacité du pergolide.
3.9 Voies d'administration et posologie
Voie orale, administration une fois par jour.
Pour une administration facilitée, la dose journalière peut être placée dans un peu d'eau, et/ou mélangée avec de la mélasse ou un autre produit sucré, et agitée jusqu'à dissolution. Dans ce cas, les comprimés dissous dans l'eau doivent être administrés avec une seringue. Administrer la quantité totale immédiatement. Les comprimés ne doivent pas être écrasés, voir la rubrique « Précautions particulières d’emploi ». Lorsque les comprimés sont divisés, la portion de comprimé restante doit être administrée lors de la prochaine administration.
Dose initiale :
La dose initiale est d’environ 2 µg de pergolide par kg de poids vif (fourchette posologique : 1,7 à 2,5 µg/kg ; voir le tableau ci-dessous). La dose d’entretien devra ensuite être ajustée en fonction de la réponse individuelle, telle que déterminée par le suivi (voir ci-dessous), pour parvenir à une dose d’entretien moyenne de 2 µg de pergolide par kg de poids vif, avec une fourchette posologique de 0,6 à 10 µg de pergolide par kg de poids vif.
Les doses initiales recommandées sont les suivantes :
Poids du cheval | Nombre de comprimés | Dose initiale | Doses extrêmes |
200 - 300 kg | ½ | 0,5 | 1,7 - 2,5 |
301 - 400 kg | ¾ | 0,75 | 1,9 - 2,5 |
401 - 600 kg | 1 | 1,0 | 1,7 - 2,5 |
601 - 850 kg | 1 ½ | 1,5 | 1,8 - 2,5 |
851 - 1 000 kg | 2 | 2,0 | 2,0 - 2,4 |
Dose d'entretien :
Cette pathologie nécessite un traitement à vie.
La majorité des chevaux répondent au traitement et sont stabilisés à la dose moyenne de 2 µg de pergolide par kg de poids corporel. L'amélioration clinique avec le pergolide est attendue dans un délai de 6 à 12 semaines. Certains chevaux peuvent répondre cliniquement à des doses inférieures ou différentes ; c'est pourquoi il est recommandé d'ajuster la posologie individuellement jusqu'à la plus petite dose efficace, en se basant sur la réponse au traitement, évaluée sur l'efficacité ou les signes d'intolérance. Certains chevaux peuvent nécessiter des doses allant jusqu'à 10 µg de pergolide par kg de poids corporel et par jour. Dans ces situations rares, il est conseillé de mettre en place un suivi plus poussé.
Après le diagnostic initial, répéter les tests endocriniens pour l'ajustement de la dose et le suivi du traitement, à intervalles de 4 à 6 semaines jusqu'à stabilisation ou amélioration des signes cliniques et/ou des tests endocriniens.
Si les signes cliniques ou les tests diagnostiques ne se sont pas améliorés après les premières 4 à 6 semaines de traitement, la dose totale journalière peut être augmentée de 0,25 - 0,50 mg. Si les signes cliniques se sont améliorés mais pas encore normalisés, le vétérinaire peut décider d’ajuster ou non la dose, en considérant la réponse/tolérance de l’animal à cette dose.
Au cas où les signes cliniques ne sont pas contrôlés de façon satisfaisante (évaluation clinique et/ou tests diagnostiques), il est recommandé d’augmenter la dose totale journalière par paliers de 0,25 - 0,50 mg (si le médicament est toléré à cette dose) toutes les 4 à 6 semaines jusqu’à stabilisation. En cas de signes d’intolérance, le traitement devra être suspendu durant 2 à 3 jours et réinstauré à la moitié de la dose précédente. La dose totale journalière pourra alors être réaugmentée jusqu’à l’effet clinique souhaité par paliers de 0,25 - 0,50 mg toutes les 2 à 4 semaines. En cas d’oubli d’une dose, la dose suivante devra être administrée normalement suivant la prescription.
Après stabilisation, l'animal doit être réévalué cliniquement et par des tests diagnostiques tous les 6 mois, pour contrôler le traitement et la dose. En cas d'absence apparente de réponse au traitement, le diagnostic et/ou plan de traitement doit être réévalué.
Les comprimés peuvent être divisés en 2 ou 4 parties égales afin d'assurer une administration précise. Placez le comprimé sur une surface plane, la face comportant la barre de cassure vers le haut et la face convexe (arrondie) contre la surface plane.
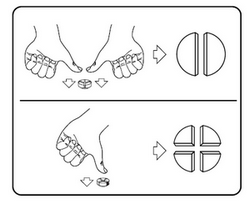
En 2 parties égales : appuyez avec vos pouces sur les deux côtés du comprimé.
En 4 parties égales : appuyez avec votre pouce sur le milieu du comprimé.
3.10 Symptômes de surdosage (et, le cas échéant, conduite d'urgence et antidotes)
Aucune donnée disponible.
3.11 Restrictions d'utilisation spécifiques et conditions particulières d'emploi, y compris les restrictions liées à l'utilisation de médicaments vétérinaires antimicrobiens et antiparasitaires en vue de réduire le risque de développement de résistance
Sans objet.
3.12 Temps d'attente
Ne pas utiliser chez les chevaux destinés à la consommation humaine.
Le cheval doit avoir été déclaré comme exclu de la consommation humaine, sur son livret d'identification, conformément aux dispositions réglementaires nationales.
Interdit chez les juments productrices de lait destiné à la consommation humaine.
4. INFORMATIONS PHARMACOLOGIQUES
4.1 Code ATCvet
QN04BC02.
4.2 Propriétés pharmacodynamiques
Le pergolide est un dérivé synthétique de l'ergot de seigle ; c'est un agoniste des récepteurs de la dopamine, puissant et à longue durée d'action. Les études de pharmacologie in vitro et in vivo ont démontré que le pergolide agit comme un agoniste dopaminergique sélectif avec peu ou pas d'effet sur les voies noradrénergiques, adrénergiques ou sérotoninergiques, aux doses thérapeutiques. Comme les autres agonistes dopaminergiques, le pergolide inhibe la sécrétion de prolactine. Chez les chevaux atteints de dysfonctionnement de la pars intermedia pituitaire (PPID), le pergolide exerce son effet thérapeutique par stimulation des récepteurs de la dopamine. De plus, chez les chevaux atteints de PPID, il a été démontré que le pergolide diminue les taux plasmatiques d'ACTH, de MSH et des autres peptides précurseurs des hormones polypeptidiques (pro-opiomélanocortiniques).
4.3 Propriétés pharmacocinétiques
Des données pharmacocinétiques chez le cheval sont disponibles, aux doses orales de 2 et 10 µg de pergolide/kg de poids corporel. Il a été démontré que le pergolide est rapidement absorbé, avec un temps d'atteinte de la concentration maximale court.
Les concentrations maximales (Cmax) après la dose de 10 µg/kg étaient faibles et variables, avec une moyenne d'environ 4 ng/mL et une demivie moyenne d'élimination terminale (T½) d'environ 6 heures. Le temps médian d'atteinte de la concentration maximale (Tmax) était d'environ 0,4 h et l'aire sous la courbe (AUC) d'environ 14 ng x h/mL.
Avec une méthode analytique plus sensible, les concentrations plasmatiques après la dose de 2 µg de pergolide/kg étaient très basses et variables, avec des concentrations maximales allant de 138 à 551 pg/mL. Les concentrations maximales se situaient à 1,25 +/ 0,5 h (Tmax). Les concentrations plasmatiques chez la plupart des chevaux n'étaient quantifiables que pendant les 5 heures suivant l'administration. Cependant, un cheval a présenté des concentrations quantifiables pendant 24 heures. Les demivies d'élimination terminale n'ont pas été calculées, car les concentrations plasmatiques en fonction du temps n'ont pas pu être déterminées en totalité pour la plupart des chevaux.
Les concentrations maximales (Cmax) après l'administration d’une dose de 4 µg/kg étaient variables allant de 0,4 – 4,2 ng/mL et une demi-vie moyenne terminale (T½) de ~ 5 heures. Les concentrations maximales sont observées à environ ~ 0.6 h (Tmax). L’aire sous la courbe (AUC) est d’environ ~3,4 ng x h/mL.
Le mésilate de pergolide est associé approximativement à 90% aux protéines plasmatiques chez les humains et les animaux de laboratoire.
Propriétés environnementales
5. DONNÉES PHARMACEUTIQUES
5.1 Incompatibilités majeures
Sans objet.
5.2 Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente: 3 ans.
5.3 Précautions particulières de conservation
Ce médicament vétérinaire ne nécessite pas de conditions particulières de conservation.
5.4 Nature et composition du conditionnement primaire
Plaquette OPA/aluminium/PVC-aluminium.
5.5 Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou [dans les ordures ménagères].
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
6. NOM DU TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
CP-PHARMA HANDELSGESELLSCHAFT MBH
OSTLANDRING 13
31303 BURGDORF
ALLEMAGNE
7. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
FR/V/9998319 6/2022
Boîte de 6 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 13 plaquettes thermoformées de 7 comprimés quadrisécables
Boîte de 10 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 16 plaquettes thermoformées de 10 comprimés quadrisécables
Boîte de 24 plaquettes thermoformées de 10 comprimés quadrisécables
Toutes les présentations peuvent ne pas être commercialisées.
8. DATE DE PREMIÈRE AUTORISATION
16/12/2022
9. DATE DE LA DERNIÈRE MISE À JOUR DU RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
20/12/2024
MARCHES LIMITES
CIRCONSTANCES EXCEPTIONNELLES
10. CLASSIFICATION DES MEDICAMENTS VETERINAIRES
Médicament vétérinaire soumis à ordonnance.
Des informations détaillées sur ce médicament vétérinaire sont disponibles dans la base de données de l’Union sur les médicaments. (https://medicines.health.europa.eu/veterinary).